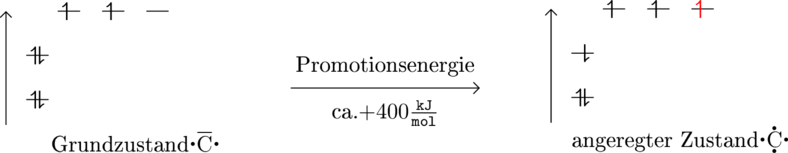
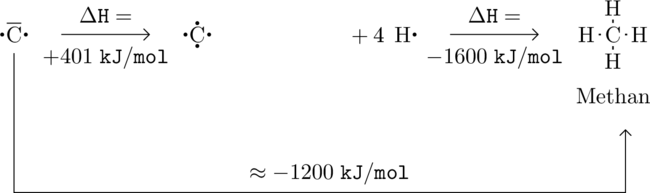Promotion von Elektronen
Als Promotion wird der Vorgang bezeichnet, bei dem Elektronen in höher liegende Orbitale bewegt werden und sich die Atome dementsprechend im angeregten Zustand befinden. Die Promotion widerspricht der Regel, dass niedrige Orbitale zuerst besetzt werden.Ein Atom kann promoviert werden, damit es mehr Bindungen eingeht, wodurch mehr Energie entsteht, als zur Promotion verwandt worden ist und demnach das Atom im energieärmsten und deshalb stabilsten Zustand sich befindet.
Ohne Promotion kann Kohlenstoff leider nur zwei Bindungen ausbilden, weshalb von den einzelnen ungebundenen Atomen ausgehend nur
![]() frei wird:
frei wird:
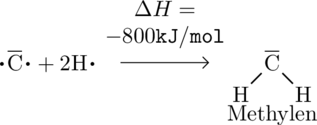
Nun können zwei weitere Bindungen geknüpft werden. Dadurch werden wiederum eine Energie von