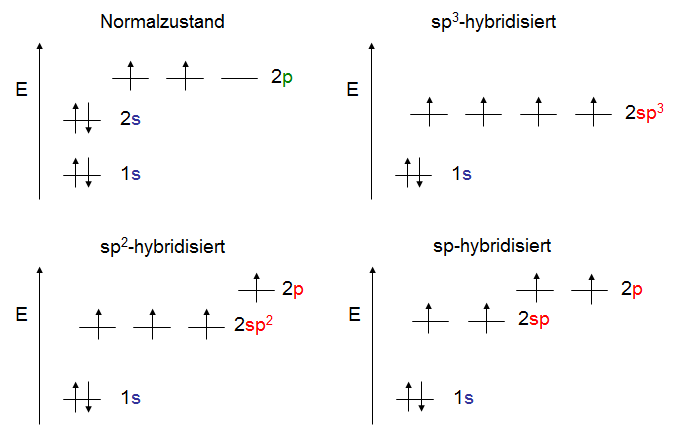
Hybridisierung
Methan liegt tetraedisch vor. Deshalb können in dem gebundenen C-Atom ein s-Orbital und drei p-Orbitale nicht in ihrer ursprünglichen Form vorhanden sein, da so die tetraedische Geometrie nicht möglich wäre. Die Hybridisierungstheorie erklärt dies mit einer Mischung der verschiedenen s- und p-Orbitale des zentralen Kohlenstoffatoms. In der organischen Chemie sind vor allen Dingen folgende drei Hybridisierungen interessant:
sp3, sp2, sp
Die Orbitale werden mathematisch wie folgt gemischt.
sp-Hybridorbital
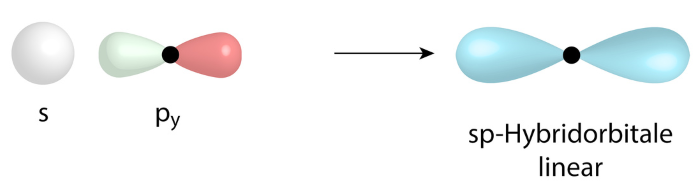
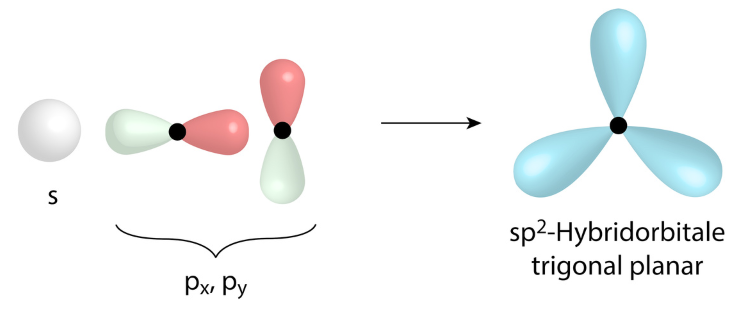
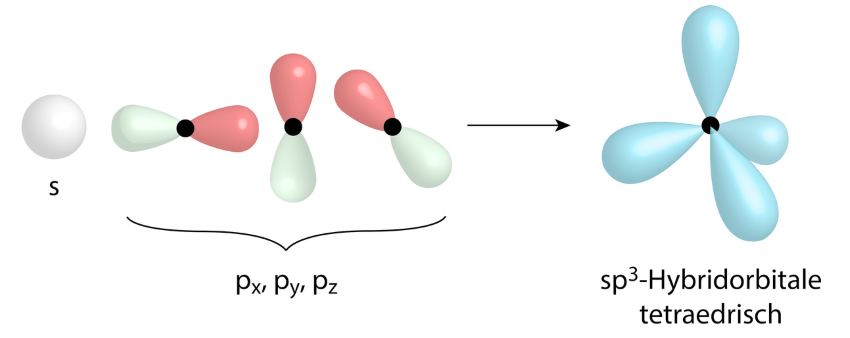
Zusätzlich sind auf dieser Seite für eine bessere Übersichtlichkeit darauf verzichtet bei den sp3-, sp2-, sp-Hybridorbitalen den jeweils entgegengesetzten Orbitallappen mit einzuzeichnen. Eines der beiden sp-Orbitale sieht beispielsweise wie folgt aus:

sp2-Hybridorbital
sp3-Hybridorbital
Hybridisierungen des Kohlenstoffes
Die unterschiedlichen Hybridisierungsstufen des Kohlenstoffes: