- Konstruktion von Molekülorbitalen
- Highest Occupied Molecule Orbital (HOMO) / Lowest Unoccupied Molecule Orbital (LUMO)
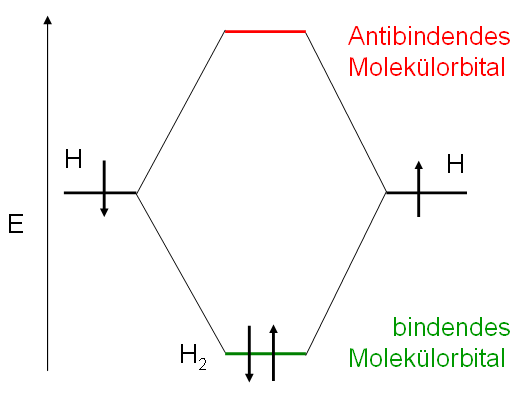
- Beispiel Wasserstoffmolekül
- Molekülorbitale verschiedener Bindungstypen
- Spinpaarungsenergie
- Wechselwirkungen und Wechselwirkungen höherer Ordnung
Molekülorbitaltheorie (MO-Theorie)
Konstruktion von Molekülorbitalen
Mit Hilfe der Molekülorbitaltheorie lassen sich Orbitale innerhalb von Molekülen beschreiben. Dabei entstehen jeweils bindende und antibindende Molekülorbitale. Es entstehen genau so viel Molekülorbitale wie die beteiligten Atome Atomorbitale haben. Die Orbitale werden mit Hilfe von Linearkombination gebildet (LCAO-Methode). Je mehr Knoten bei der Linearkombination entstehen, desto höher energetisch sind die Orbitale.
Highest Occupied Molecule Orbital (HOMO) / Lowest Unoccupied Molecule Orbital (LUMO)
Für die Bindung am meisten ausschlaggebend sind das höchste besetzte Orbital (HOMO - Highest Occupied Molecule Orbital) und das niedrigste nicht-besetzte Orbital (LUMO - Lowest Unoccupied Molecule Orbital).
Beispiel Wasserstoffmolekül
Molekülorbitale verschiedener Bindungstypen
Die Energien, die bei der Bindung frei werden, setzen sich grundsätzlich aus zwei Teilen zusammen. Einmal dem ionischen Anteil ![]() und einmal dem kovalenten Anteil
und einmal dem kovalenten Anteil ![]() . Die Gesamtenergie ist die Energie, die durch die Absenkung der Atomorbitale zum Molekülorbital beider Bindungspartner entsteht.
. Die Gesamtenergie ist die Energie, die durch die Absenkung der Atomorbitale zum Molekülorbital beider Bindungspartner entsteht.
Für eine kovalente Bindung ![]() sieht das Molekülorbital wie folgt aus (vergleiche auch oben mit dem Wasserstoffmolekül):
sieht das Molekülorbital wie folgt aus (vergleiche auch oben mit dem Wasserstoffmolekül):
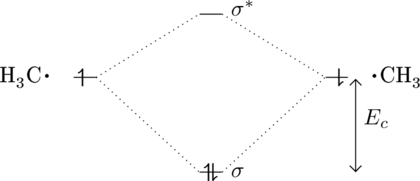
Für Ethan ist die Bindungsenergie ca ![]() .
.
Für eine polare Bindung ![]() sieht das Molekülorbital wie folgt aus:
sieht das Molekülorbital wie folgt aus:
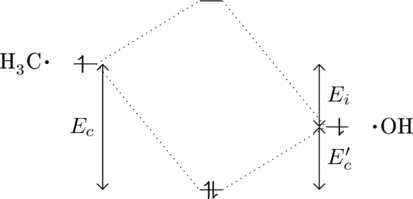
Für Methanol ist die Bindungsenergie zusammengesetzt aus
![]() . Dabei ist wie oben schon genannt
. Dabei ist wie oben schon genannt ![]() der ionische Anteil der Bindung.
der ionische Anteil der Bindung.
Für eine ionische Bindung ![]() sieht das Molekülorbital wie folgt aus:
sieht das Molekülorbital wie folgt aus:
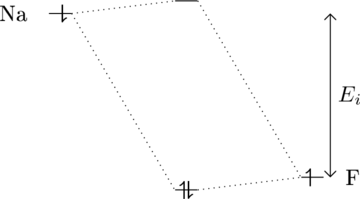
Für Natriumfluorid besteht die Bindungsenergie fast nur aus ![]() .
.
Spinpaarungsenergie
Die oben genannten Werte sind nur näherungsweise richtig. In der Tat sind noch andere Faktoren mit einzubeziehen, wie z.B. die Spinpaarungsenergie.
Befindet sich ein Elektron zusammen mit einem anderen in einem Orbital, so ist die Energie etwas höher, als wenn es sich alleine dort befinden würde. Diese Energie wird Spinnpaarungsenergie genannt.
Wechselwirkungen und Wechselwirkungen höherer Ordnung
Das antibindende Molekülorbital benötigt eine höhere Energie, als das bindende Molekülorbital liefert. Deshalb sind Wechselwirkungen, bei denen das bindende sowie das antibindende Orbital besetzt wird, von antibindender Natur:
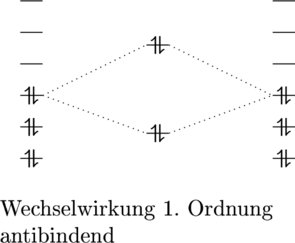
Ist hingegen nur ein Orbital, nämlich das bindende Molekülorbital besetzt, so entsteht eine bindende Wechselwirkung zwischen dem HOMO und dem LUMO:

Jedoch kann auch eine Wechselwirkung zweiter Ordnung zwischen einem tiefen Atomorbital und einem sehr hohen unbesetzten Atomorbital geschehen:
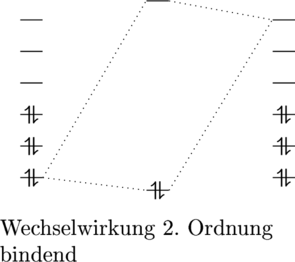
Diese Wechselwirkungen zweiter Ordnung sind jedoch nicht so stark, weshalb maßgeblich an der Stabilität des entstehenden Moleküls das HOMO und das LUMO beiträgt.