- Mesomere Grenzstrukturen (auch Resonanzformeln genannt)
- Regeln zum Aufstellen von Resonanzformeln
- Ungleichmäßige Resonanz
Mesomerie (auch Resonanz genannt)
Mesomere Grenzstrukturen (auch Resonanzformeln genannt)
Manche Moleküle kann man nicht genau in einer Strukturformeln darstellen. Mehrere fiktive Strukturformeln sind richtig, werden aber in der Realität vom Molekül nicht erreicht. Das Molekül ist real ein Hybrid, d.h. eine Mischung, aus allen Strukturformeln. Die fiktiven Strukturformeln, die an der Grenze eingenommen werden können, werden auch als Resonanzformeln oder mesomere Grenzstrukturen bezeichnet. Der Effekt wird häufig als Mesomerie oder Resonanz bezeichnet.
Alle Resonanzformeln werden in eckigen Klammern ( ![]() ) angegeben. Zwischen den einzelnen Resonanzformeln wird ein Resonanzpfeil (
) angegeben. Zwischen den einzelnen Resonanzformeln wird ein Resonanzpfeil (
![]() ) gezeichnet.
) gezeichnet.
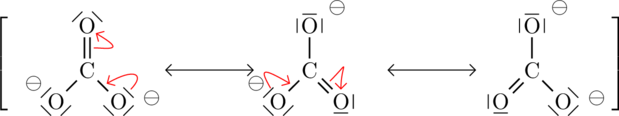
Dreht man die einzelnen Resonanzformeln, so wird man feststellen, dass diese bis auf Drehung identisch sind.
Regeln zum Aufstellen von Resonanzformeln
Häufig steht man vor der Aufgabe, Resonanzformeln aufzustellen. Resonanzformeln kann man ganz einfach aufstellen, indem man Elektronenpaare, die sich in einem Molekül befinden, umklappt. Dabei kann ein Elektronenpaar immer nur an das Nachbaratom hin umklappen, nicht über zwei Atome hinweg. Weitere Elektronenpaare, die nach dem Umklappen im Weg sind, müssen weggeschoben werden. Elektronenpaare können entweder freie Elektronenpaare sein, wie sie beispielsweise am Sauerstoffatom existieren oder können ein Elektronenpaar einer Doppelbindung sein.
Ungleichmäßige Resonanz
Bei manchen Mesomerien liegt eine Resonanzformel bevorzugt vor. Die bevorzugte Form läßt sich nach folgenden Regeln bestimmten:- Elektronenoktetts werden bevorzugt. Regel 1 sagt, dass, wenn es in einer von zwei Resonanzformeln weniger Elektronenoktetts gibt als in der anderen, diejenige mit mehr Elektronenoktetts bevorzugt vorliegt.
- Negative Ladungen sind bevorzugt an Atomen mit höherer Elektronenaffinität. Positive Ladungen bevorzugt an Atomen mit niedriger Elektronenaffinität. Spricht jedoch Regel 1 gegen diese Regel, so geht Regel 1 vor.
- Resonanzformeln mit geringer Ladungstrennung sind bevorzugt, da für eine Ladungstrennung Energie aufgewendet werden muss.
- Allerdings kann Regel 3 durch Regel 1 widersprochen werden. Die Trennung der Ladung kann durch die Oktettregel erzwungen werden.