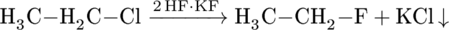- Thermodynamik
- Einordnung
- Umwandlung der Abgangsgruppe von einer schlechten zu einer guten
- Finkelstejn-Reaktion
Gute und schlechte Abgangsgruppen
Thermodynamik
Die Güte einer Abgangsgruppe ist allein thermodynamisch gesteuert. Auch die Basizität eines Moleküls ist eine thermodynamische Größe. Deshalb läßt sich anhand der Basizität eines Moleküls auf seine Eigenschaft als gute oder schlechte Abgangsgruppe schließen.Innerhalb des Periodensystems nimmt die Basizität von links nach rechts zu, von oben nach unten hin ab. Negative Ladung erhöht die Basizität enorm. Größere Atome haben eine geringere Basizität, weil sie aufgrund ihrer Größe diese besser verteilen können (weshalb nach unten hin im Periodensystem diese abnimmt). Resonanzstabilisierte Ionen haben eine geringe Basizität, weil sie die negative Ladung verteilen können.
Einordnung
Die Güte der Abgangsgruppe beeinflusst die Geschwindigkeit der Reaktion. Verlässt die Abgangsgruppe das Molekül sehr schnell, so ist die Reaktion schnell; umgekehrt langsam.Abgangsgruppen sind Basen. Es gibt gute und schlechte Basen. Eine gute Base zieht nach Brönsted sehr gut Protonen an. Eine schlechte Base kann ihre Elektronen gut stabilisieren, so dass Protonen nicht so sehr angezogen werden. Ebenso verhält es sich mit der Base als Abgangsgruppe. Je schlechter die Base ist ist, desto besser fungiert sie als Abgangsgruppe.
Wir erinnern uns, dass die Stärke der Base negativ korreliert mit der Stärke der konjugierten Säure ist; dies bedeutet, dass wenn ![]() eine schwache Base darstellt,
eine schwache Base darstellt, ![]() eine starke Säure ist. Dies ist so, weil die Protonen entsprechend von der Base nicht angezogen werden und dementsprechend ,,frei'' sind.
eine starke Säure ist. Dies ist so, weil die Protonen entsprechend von der Base nicht angezogen werden und dementsprechend ,,frei'' sind.
Wegen der abnehmenden Stärke der Base nimmt das Austrittsvermögen in der Gruppe nach unten hin zu zu. Bei dem Halogenen konkret: Fluor ist eine sehr schlechte Abgangsgruppe. Iod hingegen ist eine sehr gute Abgangsgruppe:
Aber nicht nur einzelne Atome können Abgangsgruppen sein, sondern auch ganze Molekülreste, die manchmal etwas übersehen werden können, da sie größer ausarten können, als das Hauptmolekül selbst ist. Einige sehr wichtige weitere gute Abgangsgruppen sind die folgenden Sulfonate und ähnliche. Wir kennen ähnliche Strukturen aus der Schwefelsäure und deren Derivate. Diese Säuren sind gerade so stark, weil die Base schwach ist, da sie über Resonanz die Ladung stabilisieren kann. Sie dienen als Abgangsgruppen, da sie über Resonanz die negative Ladung stabilsieren:
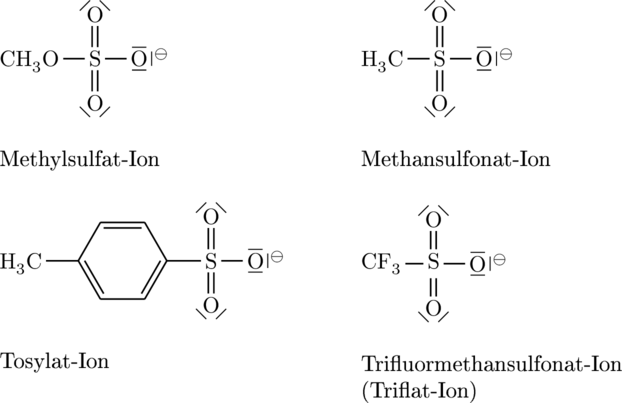
Methylsulfat-Ion, Methansulfonat-Ion (Mesylat-Ion),
Tosylat-Ion, Trifluormethansulfonat-Ion (Triflat-Ion)
Ebenso gibt es auch schlechte Abgangsgruppen. Schlechte Abgangsgruppen sind beispielsweise:
Umwandlung der Abgangsgruppe von einer schlechten zu einer guten
Manchmal kann man einen Trick anwenden, um eine schlechte Abgangsgruppe im Molekül in eine gute Abgangsgruppe umzuformen:
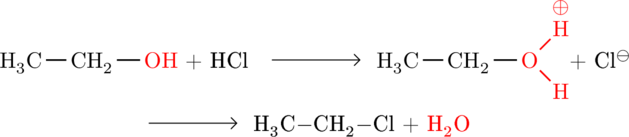
Wasser (![]() ) ist eine sehr gute Abgangsgruppe. Die
) ist eine sehr gute Abgangsgruppe. Die ![]() -Gruppe ist eine schlechte Abgangsgruppe. Allerdings kann sie mit Hilfe einer Säure protoniert werden. Damit kann sie als
-Gruppe ist eine schlechte Abgangsgruppe. Allerdings kann sie mit Hilfe einer Säure protoniert werden. Damit kann sie als ![]() bei der Substitution als Abgangsgruppe austreten. Dies ist eine sehr wichtige Reaktion, um Alkohole in Halogenalkane zu überführen.
bei der Substitution als Abgangsgruppe austreten. Dies ist eine sehr wichtige Reaktion, um Alkohole in Halogenalkane zu überführen.
Eine Alkansulfonatgruppe kann anstelle der OH-Gruppe eingefügt werden, indem man mit einem Alkansulfoxylchlorid arbeitet. Dies ist eine gute Abgangsgruppe, die sehr gut in einer ![]() -Folgereaktion wieder abgetrennt werden kann.
-Folgereaktion wieder abgetrennt werden kann.

Finkelstejn-Reaktion
SSomit können Chloralkane in Iodalkane oder Fluoralkane umgewandelt werden. Da Iod hochselektiv bei der radikalischen Substitution ist, ist dies vor allen Dingen interessant, wenn primäre Iodalkane gebildet werden müssen. In der folgenden Austauschreaktion sind beide Kohlenstoffatome jedoch gleichwertig, so dass dies nicht ins Gewicht fällt:
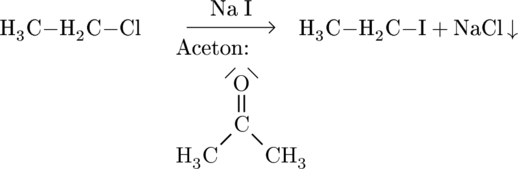
Auch Fluor ist ein schlechtes Nukleophil. Es kann aber trotzdem wie folgt in einer ähnlichen Austauschreaktion eingebunden werden: