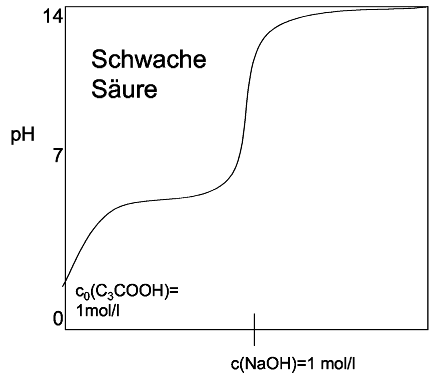
Neutralisation von starken und schwachen SäurenSäuren kann man mit Basen neutralisieren. Es entsteht dabei ein Salz. Die Lösung hat am Neutralpunkt einen PH-Wert vonDie Titration ist eine Möglichkeit die Stoffmenge einer Säure bzw. Base zu bestimmen. Bei dieser tropft man Tropfenweise eine Base bzw. Säure in die Lösung, deren Konzentration bekannt ist und mißt den PH-Wert. Hat man den Neutralpunkt erreicht, so kann man anhand der verwendeteten Stoffmenge an Neutralisationsmittel errechnen, wieviel Mol Säure oder Base vorhanden waren. Titrationskurven von starken Säuren/Basen und schwachen Säuren/Basen verlaufen nicht gleich: 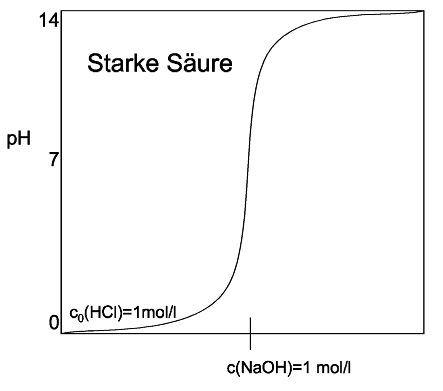
|