Unterabschnitte
AtommodellePlanetenmodell von RutherfordDas Elektron befindet sich wie ein Planet auf einer konstanten Kreisbahn um den Kern. Die elektrische Anziehungskraft (Zentralkraft) muß somit die Zentrifugalkraft genau aufheben (Kräftegleichgewicht). Mit der Zentrifugalkraft wird das Elektron vom Kern weggetrieben:Die elektrostatische Anziehungskraft wird mit Hilfe des Coulombschen Gesetzes beschrieben: Wir setzen ein:
Die Zentrifugalkraft ist Somit folgt: Schalenmodell von BohrVerschiedene Versuche ließen sich nicht mit dem von Rutherford entwickelten Atommodell erklären. Zum Beispiel sind die Spektren von Wasserstoffatomen und von anderen Atomen nicht erklärbar. Weiterhin war auch dieses Atommodell nur im Einklang zur klassischen Mechanik, aber im Wiederspruch zur klassischen Elektrodynamik, da das Elektron laufend Energie verlieren müßte und in den Kern spriralförmig stürzen müßte, was es aber nicht tut.Niels Bohr postulierte, daß sich das Elektron nur auf bestimmten Bahnen im Atom bewegen kann. Er postulierte, daß auf diesen Bahnen das Elektron keine Energie verliert. Diese Bahnen sind solche bei denen die Energie des Elektrons ein ganzzahliges Vielfaches des Bahndrehimpluses ist: wobei Nun formt man diese Gleichung nach Setzt man nun diese Gleichung in die Balance-Gleichung zwischen Zentrifugalkraft und elektrischer Anziehungskraft ein und löst nach Erklärung des Spektrums der Wasserstoffatome mit der Bohrschen TheorieMit Hilfe des Schalenmodells gelingt es uns, die Wellenspektren des Wasserstoffatoms zu erklären. Hierfür berechnen wir zunächst die Engerie eines Elektrons. Diese setzt sich zusammen aus potenzieller Energie und kinetischer EnergieDie kinetische Engerie ist die Energie, die durch die Bewegung des Elektrons zustandekommt Die potenzielle Energie ist die Energie, die durch die elektrische Anziehung zustandekommt Man erhält Wir setzen für die möglichen Energiewerte des Elektrons. Regt man Wasserstoffatome an, so strahlen sie Licht aus. Dieses Licht hat jedoch nicht das gesamte Spektrum, sondern es besteht aus Spektrallinien: 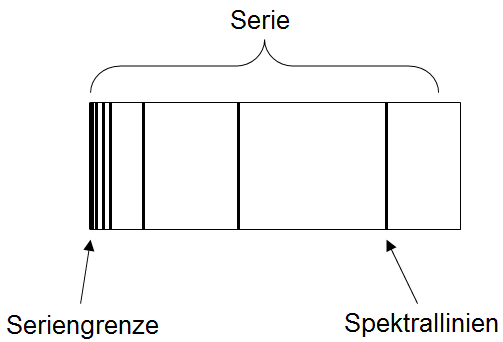
Es gibt verschiedene Serien: Die Balmerserie im sichtbaren Bereich, die Lyman-Serie im ultravioletten Bereich, sowie die Paschen und Bracket Serien im infraroten Bereich: 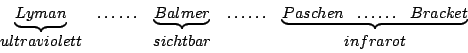
aufgestellt, wobei Die Rydbergkonstante läßt sich nun nicht nur wie von Rydberg experimentell bestimmen, sondern sie läßt sich berechnen: Durch Einsetzen der Planckschen Gleichung für Mit Hilfe der Bohrschen Theorie ist es uns gelungen eine Erklärung für die Spektren der Wasserstoffatome zu finden. Die Elektronen der Wasserstoffatome können nur in ganz bestimmten Energiezuständen sich befinden. Wechseln sie von einem höheren Energiezustand zu einem niederen Energiezustand, so tun sie dies sprunghaft und strahlen dabei einen Lichtquanten mit einer bestimmten Wellenlänge ab, welche man dann im Spektrum sehen kann. Wellenmechanisches AtommodellMit dem Bohrschen Atommodell waren zwar einfache Wasserstoffatome erklärbar geworden, aber Atome mit mehr Elektronen waren nicht erklärbar. Broglie, Heisenberg, Schrödinger u.a. schufen deshalb ein leistungsfähigeres Atommodell: Das Wellenmechanische Atommodell.Heisenberg stellte die Unbestimmtheitsbeziehung auf, die sagt, daß es unmöglich ist, Ort und Drehimpuls des Elektrons gleichzeitig zu bestimmen. Es ist in dem modernen Atommodell hinfort unmöglich genau zu sagen, wo sich ein Elektron befindet. Das Elektron umkreist nicht mehr in vorher genau festgelegten Bahnen den Atomkern, sondern es ist in einem (kleinen) Bereich der Elektronenhülle mit einer bestimmten Wahrscheinlichkeit anzutreffen. Die Aufenthaltswahrscheinlichkeit eines Elektrons in der Kugel vom Radius Hierbei sinkt die Wahrscheinlichkeit des Antreffens mit der Entfernung vom Kern laufend ab, wird aber nicht Zusätzlich zu der Unbestimmtheitsbeziehung kommt noch der Wellencharakter des Elektrons. Ein Elektron kann eine Welle oder ein Teilchen sein, je nachdem aus welcher Sichtweise man es betrachtet. Das Elektron legt sich als eine dreidimenional stehende Welle um den Atomkern. Hierbei können nur solche Wellen ,,stehen'', welche sich nicht selbst zerstören, d.h. wenn die Welle um den Atomkern einmal ,,rum'' ist, dann muß sie die selben Schwingungen haben, wie das andere Ende der Welle, um sich am Anfang der Welle nicht auszugleichen. Zwischen Wellenlänge und Impuls eines Teilchens besteht die Beziehung (de Broglie-Beziehung) Ein ganzes Vielfaches der Wellenlänge muß exakt die Kreisbahn ergeben: Die vier QuantenzahlenSchrödinger stellt die berühmte Wellengleichung auf, welche die dreidimensionalen Wellen eines Atoms berechnen kann. Bei dem lösen dieser Schrödingergleichung ergeben sich vier Quantenzahlen:
SchrödingergleichungDie Schrödingergleichung sieht folgendermaßen aus: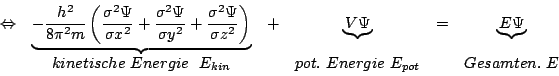
wobei
Einfacher schreibt man wobei
Die durch die Lösung der Schrödingergleichung entstehenden Wellenfunktionen 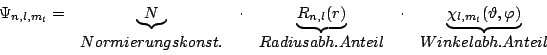
Ein Beispiel für eine solche Funktion ist die Winkelfunktion für das Der radiale Anteil zusammen mit der Dichte6 gezeichnet. Die Nullpunkte sind die Knotenflächen des Oribtals7: 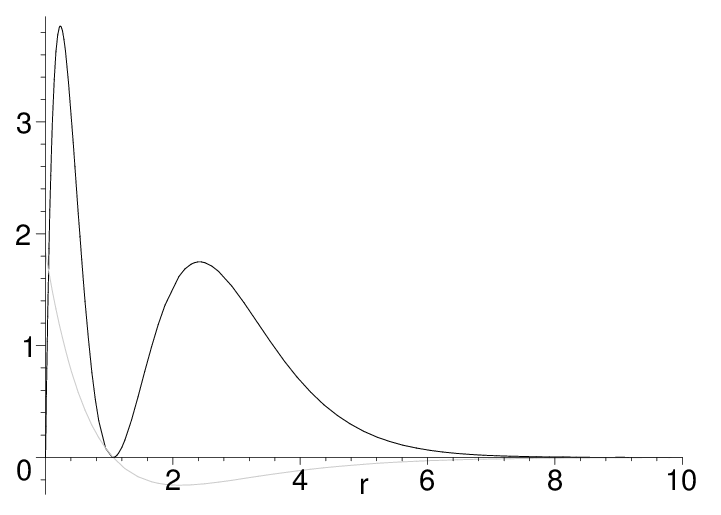
Aus den unterschiedlichen Eigenfunktionen ergeben sich die Atomorbitale. Einige Atomorbitale sind unten in der Grafik aufgezeichnet. 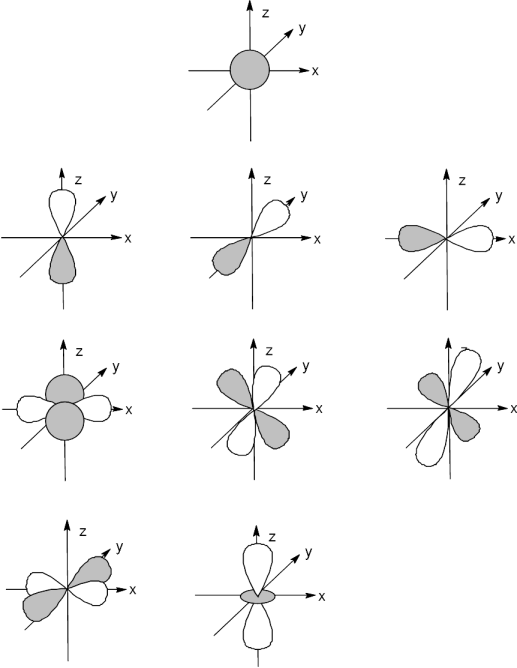
Von links nach rechts, von oben nach unten: Zur Ergänzung und weiterer Verdeutlichung eine weitere Darstellung: 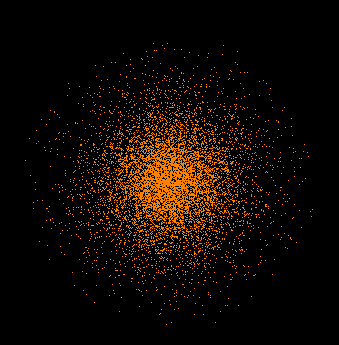 Punktwolke des 1s-Orbitals 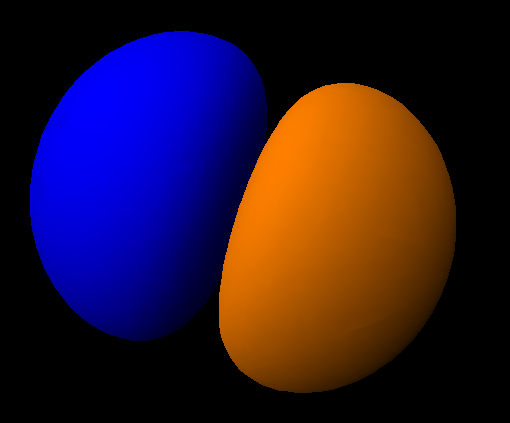 Darstellung eines der drei 2p-Orbitale. Diesmal nicht mehr als Punktwolke, sondern bei einer bestimmten Wahrscheinlichkeit abgeschlossen. Das Ganz besonders deutlich wird der Leerraum im Zentrum. Hier herunterladen Spielbar mit dem Quicktime-Player. |