Unterabschnitte
Wasserstoffbrückenbindungen können zwischen einem Wasserstoffatom und einem weiteren elektronegativem Atom auftreten.
Die Brückenbindung ist umso stärker je kleiner und elektronegativer das
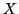
-Atom ist. Starke Wasserstoffbrückenbindungen werden zwischen
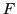
,
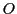
und
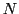
geknüpft. Eine Wasserstoffbrückenbindung zwischen
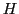
und
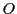
ist für die Eiskristalle des Wassers und die Ausdehnung des Wassers bei niedriger Temperatur verantwortlich. Schwache Wasserstoffbrückenbindungen können zu den
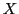
-Atomen
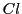
,
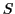
,
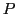
und
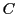
geknüpft werden. Meistens ist das freie Elektronenpaar des
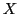
-Atoms nur zur Ausbildung einer Wasserstoffbrückenbindung in der Lage.
Dipol-Dipol-Wechselwirkungen treten zwischen Molekülen mit polarisierten kovalenten Bindungen auf. Die Moleküle richten sich entsprechend den Dipolenden aus.
Auch bei unpolaren kovalenten Bindungen gibt es Dipol-Wechselwirkungen. Diese kommen aufgrund der momentanen Ladungsverteilung in einem Molekül oder Atom zustande. Ist die Ladung momentan zufällig auf der anderen Seite des Moleküls, so induziert dies eine Ladung des Nachbarmoleküls usw.. Je größer das Molekül oder Atom ist, desto leichter läßt sich seine Hülle deformieren, desto stärker werden die London-Kräfte.