- Der Reaktionsverlauf ist abhängig vom Erstsubstituenten
- Induktive Effekte - (I)-Effekte
- Resonanzeffekte - (M)-Effekte
- Übersicht über die Effekte der wichtigsten Gruppen
- Aktivierung und Deaktivierung des Ringes
- Stellung des Zweitsubstituenten
- Mehrere Erstsubstituenten
Elektrophile Zweitsubstitution am Benzenring
Der Reaktionsverlauf ist abhängig vom Erstsubstituenten
Ist schon ein Substituent in den Benzenring eingefügt, so verhält sich der Rest des Benzenringes bei der Zweitsubstitution anders als bei der Erstsubstitution. Weiterhin stellt man fest, dass er unterschiedliches Verhalten bei unterschiedlichen Substituenten hat. Einige Substituenten beschleunigen die Reaktion. Sie wirken aktivierend. Andere verlangsamen sie. Einige Substituenten verursachen eine Zweitsubstitution des neuen Substituenten an ganz bestimmten Stellen, während wiederum die andere Art eine andere Stelle bevorzugt. Um dieses Verhalten zu erklären, schauen wir uns zunächst die Effekte an, die Substituten auf den Ring haben, um danach das unterschiedliche Verhalten zu begründen.
Induktive Effekte - (I)-Effekte
Induktive Effekte werden über die

Der induktive Effekt, durch den ein Substituent elektropositiver wird, der also Ladung in den Ring abgibt, wird auch (+)-I-Effekt genannt. Ein (-)-I-Effekt ist dementsprechend ein Elektronenabzug durch den Substituenten.
Resonanzeffekte - (M)-Effekte
Die induktiven Effekte werden jedoch weit von den Resonanzeffekten übertroffen. Diese übertragen sich über dasDie Hydroxygruppe in Phenol ist ein Beispiel für einen Elektronendonor:
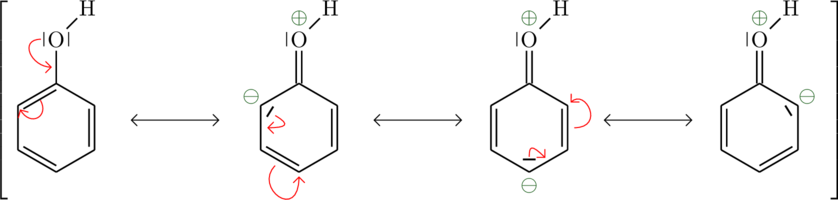
Die Carboxylgruppe der Benzoesäure ist ein Beispiel für einen Elektronenakzeptor:
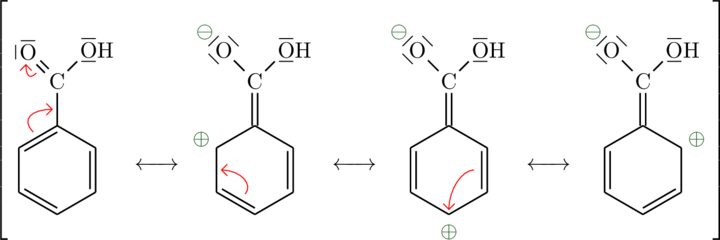
Man nennt den Effekt des Elektronenakzeptors auch (-)-M-Effekt. Er nimmt Elektronenladung auf.
Übersicht über die Effekte der wichtigsten Gruppen
Aus folgender Tabelle lassen sich die Effekte, die einzelne Substituenten verursachen entnehmen:| (+)-M-Substituenten |
| Stärke nimmt ab |
| Phenylrest |
| (-)-M-Substituenten |
| Stärke nimmt zu |
Halogene nehmen eine Sonderstellung ein. Hier spielen die induktiven Effekte gegen die mesomeren Effekte des Halogens. In der Gruppe nach unten nimmt die Elektronegativität des Halogens ab. Fluor hat die stärkte Elektronegativiät. Demnach wäre zu erwarten, dass aufgrund des sinkenden (-)-I-Effektes die Elektronendonor-Eigenschaft steigt und das Halogen mehr Elektronendichte in den Ring drückt. Allerdings nimmt gleichermaßen der (+)-M-Effekt des Halogens ab. Da sich die Orbitale mit steigender Molekülgröße des Halogen-Atoms nicht mehr gut überlappen, kann der Elektronenausstausch nicht mehr so gut stattfinden. Somit sind Halogene mit steigender Größe immer mehr einem (-)-Effekt unterworfen.
Aktivierung und Deaktivierung des Ringes
Durch Substituenten, die Ladung in den Ring hinein drücken, die also einen (+)-Effekt ausüben, wird der Ring aktiviert. Dadurch wird die elektrophile Zweitsubstitution beschleunigt. Ziehen Substituenten Ladung, so gibt dies einen (-)-Effekt und der Ring wird deaktiviert und die Zweitsubstiution wird verlangsamt. Sowohl für die Reaktionsgeschwindigkeit als auch für die Stellung des Zweitsubstituenten (dazu unten mehr) sind die M-Effekte ausschlaggebender als die I-Effekte.Halogene nehmen wegen den beiden konkurrierenden Effekten eine Sonderstellung als schwach desaktivierend ein, dirigieren aber dennoch, wie im nachfolgenden Abschnitt beschrieben in ortho- und para-Stellung.
Stellung des Zweitsubstituenten
Es gibt drei Stellen, an denen relativ zum Erstsubstituenten der Zweitsubstituent gebunden werden kann. Diese Stellungen werden als Ortho-, Meta-, und Para-Stellung bezeichnet und auch als o (für Ortho), m (für Meta) und p (für Para) abgekürzt werden.

Ist der Ring aktiviert, d.h. ihm wurde durch einen Substituenten mit einem (+)-Effekt Elektronendichte hinzugefügt, so findet eine Zweitsubstitution überwiegend an der Ortho- und Para-Stellung statt. Ist der Ring desaktiviert, d.h. ihm wurde durch einen (-)-Effekt Elektronendichte entzogen, so findet eine Zweitsubstitution an der Meta-Stellung statt (vorrausgesetzt, es findet überhaupt eine Reaktion statt).
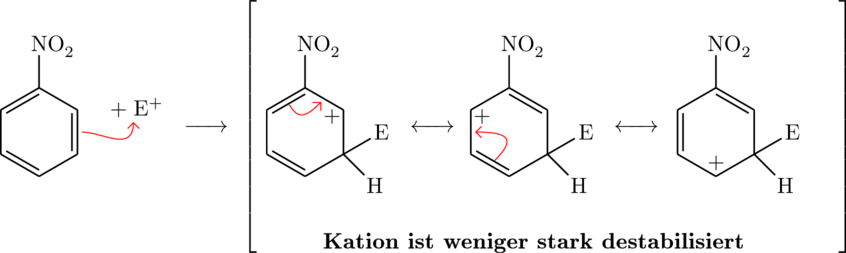
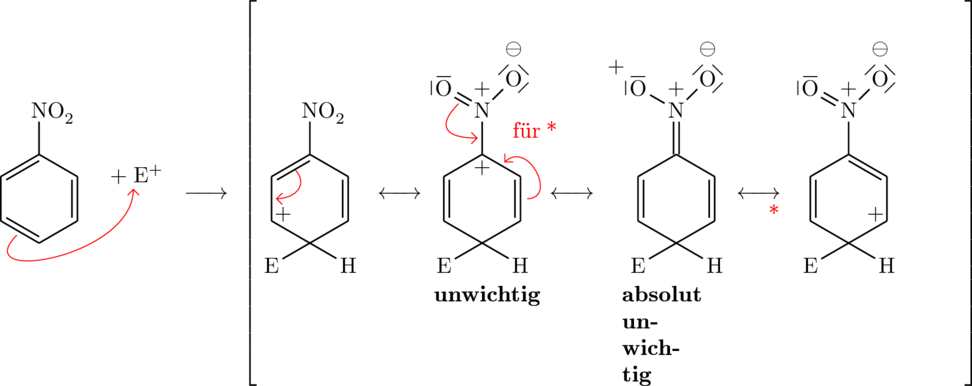
Der Grund weshalb die Substitutionen genau so stattfinden, liegt in der Stabilität der einzelnen Kationen, genauer gesagt einer derer Grenzformeln. Kann ein Übergangszustand mit Hilfe der Resonanz sich in einer Grenzformel besonders gut stabilisieren, so gibt es auch viele Produkte dieses Übergangszustandes. Bei den (+)-Effekten ist dies der Fall, wenn eine positive Ladung zum Erstsubstituenten geschoben werden kann oder nahe an diesem liegt. Dadurch wird der Ring stabilisiert. Es gibt hier keine stabile Resonzanzformel für die Meta-Variante, weshalb sie sehr wenig gebildet wird. Für (-)-Erstsubstitutenten muss die positive Ladung möglichst weit vom Erstsubstituenten weg liegen, damit sie einigermaßen stabil ist. Der Effekt der für (+)-Effekte genau ortho und para-Stellungen verursacht hat, verhindert hier, dass diese Stellungen auftreten. Eine positive Ladung ist ungern am negativen Erstsubstituenten.
Grenzformeln für den (+)-M-Effekt bei einer Substitution von einem Elektrophil ![]() an Phenol (Hydroxybenzen):
an Phenol (Hydroxybenzen):
Ortho-Stellung:

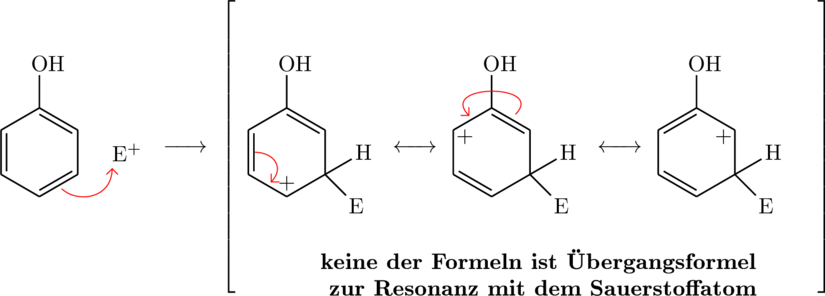

Grenzformeln für den (-)-M-Effekt bei einer Substitution von einem Elektrophil ![]() an Nitrobenzen:
an Nitrobenzen:
Ortho-Stellung:
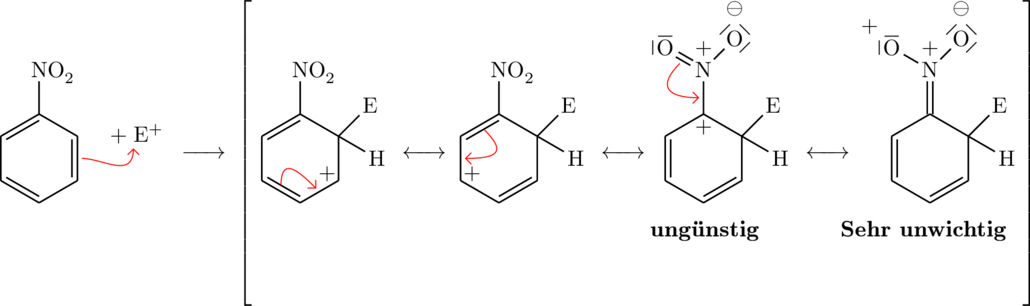
Mehrere Erstsubstituenten
Wenn schon mehrere Substitutenten am Benzenring vorhanden sind und ein weiterer neuer Substitutent eingeführt werden soll, dann wirken die Effekte der anderen Substitutenten additiv aufeinander. Dies bedeutet, dass wenn zwei Substituenten den neuen Substituenten an eine neue Stelle dirigieren, dieser doppelt so gut dort auch reagiert. Wenn zwei Substituenten den neuen Substituenten wegdirigieren, wird er auch dort nicht reagieren. Wenn die Substituenten entgegengesetzte Effekte haben, ,,gewinnt'' der Stärkere der beiden.