Regioselektivität der Halogenierung bei Vorhandensein von sekundären und tertiären Kohlenstoff-Wasserstoff-Bindungen
Schon bei Propan gibt es zwei unterschiedliche Stellen, an welchen das Propanmolekül zu einem Radikal werden kann. Man findet beim Propanmolekül primäre und sekundäre Wasserstoffatome an Kohlenstoffatomen. Ist das Alkan verzweigt, so findet man zusätzlich sogar tertiäre Wasserstoffatome an Kohlenstoffatomen. Die radikalische Substitution ist eine Reaktion, welche aus mehreren Schritten aufgebaut ist. Je stabiler das Alkanradikal, welches im ersten Schritt gebildet wird, ist, desto niedriger ist die Energiebarriere zwischen den Edukten und Produkten und desto mehr reagiert dieses Alkanradikal im Gegensatz zu den anderen Alkanradikalen. Dieser Effekt nimmt mit steigender Temperatur des Reaktionsgemisches ab, d.h. bei hohen Temperaturen wirken sich die Unterschiede nicht mehr so stark aus.
Die Stabilität des Radikals nimmt von einem primären, zu einem sekundären bis hin zu einem tertiären Radikal zu. Ist keine Alkylgruppe vorhanden, so ist das geladene C-Atom quasi ungeschützt und somit ist dieses Radikal recht instabil. Befindet sich eine, zwei, drei, oder vier Alkylgruppen im Umkreis des Atoms, so wird das Radikal immer stabiler, weil die Ladung mehr geschützt wird. Der Schutz kommt zustande, indem das ![]() -Orbital des Nachbaralkylrestes den Aufenthaltsbereich des einsamen Elektrons überlappt und dieses Elektron somit einen größeren Aufenthaltsbereich bekommt. Somit sind die Produk
-Orbital des Nachbaralkylrestes den Aufenthaltsbereich des einsamen Elektrons überlappt und dieses Elektron somit einen größeren Aufenthaltsbereich bekommt. Somit sind die Produk
Weiterhin ausschlaggebend für die Verteilung der Produkte zwischen primären, sekundären und tertiären Halogenalkanen ist auch die Reaktivität des jeweils zum Einsatz kommenden Halogens. Ist dessen Reaktivität hoch, so spielt die Stabilität des Radikals keine Rolle mehr, da sowieso schnell reagiert wird. Ist die Reaktivität sehr niedrig, so ist der Stabilität ein hoher Stellenwert beizumessen. Die Auswirkung des zum Einsatz kommenden Halogens läßt sich an folgender Tabelle ablesen:
| primär | sekundär | tertiär | |
| Fluor (bei 25^C) | 1 | 1,2 | 1,4 |
| Chlor (bei 25^C) | 1 | 4 | 5 |
| Brom (bei 98^C) | 1 | 250 | 6300 |
Als letztes ist die statistische Wahrscheinlichkeit für die Verteilung der Produkte ausschlaggebend. Wir haben schon beim Methan gesehen, dass das Methanmolekül vier verschiedene Wasserstoffatome besitzt, die alle mit der gleichen Wahrscheinlichkeit reagieren können. Im Prinzip würde es vier verschiedene Produkte geben, welche allerdings alle durch Rotation ineinander überführt werden können und deshalb gleich sind. Bei höheren Alkanen gibt es auch verschiedene Wasserstoffatome, welche bei einer Substitution die gleichen Halogenalkane ergeben. Ebenso aber gibt es auch verschiedene Wasserstoffatome, welche unterschiedliche Halogenalkane ergeben. Die Wasserstoffatome, deren Substitution das gleiche Halogenalkan ergeben sind für jedes Halogenalkan-Produkt zu zählen und im Verhältnis zueinander zu setzen.
Beispiel: Wir wollen eine Bromierung durchführen. Betrachten wir folgendes Molekül:
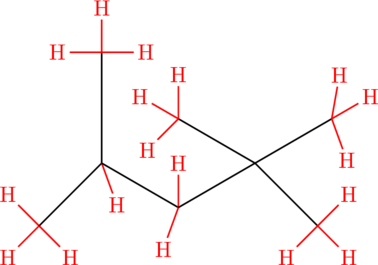
Wir finden an dem Molekül 15 primäre Wasserstoff-Atome, 2 sekundäre und 1 tertiäres. Ein Kohlenstoffatom trägt gar keine Wasserstoffatome, sondern hat nur Bindungen zu Kohlenstoffatomen.
Bei den primären Wasserstoffatomen gibt es nun zwei verschiedene Möglichkeiten für das Produkt-Molekül: Die sechs Wasserstoffatome auf der linken Seite reagieren zu folgendem Molekül (1):

Wenn wir alle Wasserstoffatome betrachten, dann wird uns auffallen, dass alle primären Wasserstoffatome auf der linken Seite gleichwertig sind. Sie reagieren zu ein und demselben Molekül, da wir alle C-C-Bindungen beliebig drehen können.
Auf der rechten Seite reagieren neun primäre Wasserstoffatome zu folgendem Molekül (2). Zusammen haben wir also 15 primäre Wasserstoffatome:
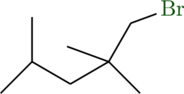
Die beiden sekundären Wasserstoffatome reagieren zu folgendem Molekül (3):
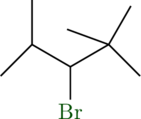
Das eine tertiäre Wasserstoffatom reagiert zu folgendem Molekül (4):

Aus der Tabelle für die Regioselektivität der Halogene lesen wir nun ab, dass für Brom bei einer Reaktion bei 98^C folgende Verteilung zwischen primär:sekundär:tertiär gilt:
| Molekülnummer | Anteil | prozentualer Anteil |
| (1) |
|
|
|---|---|---|
| (2) |
|
|
| (3) |
|
|
| (4) |
|
|
| Summe: |