Reaktionsenthalpiediagramm einer radikalischen Substitution von Methan und Chlor
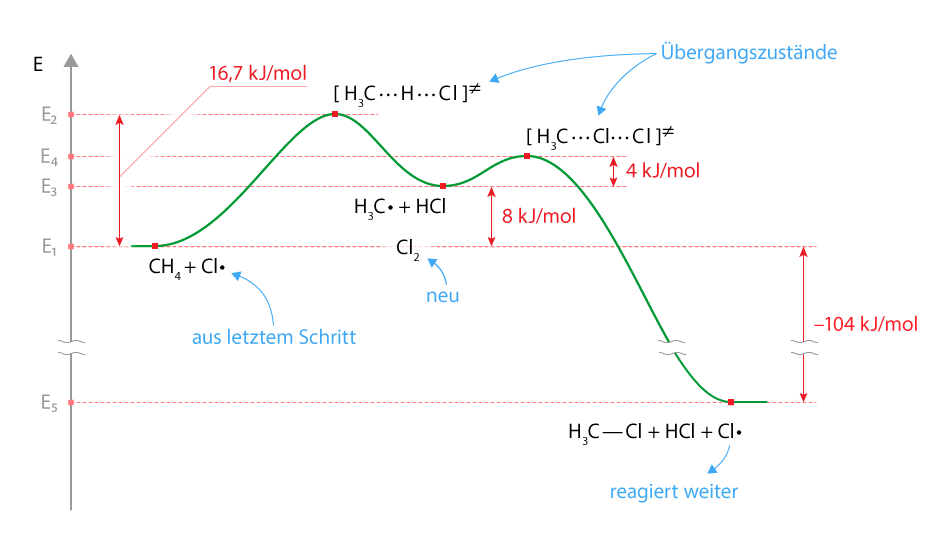
- An den Energiemaxima des Energiediagrammes finden immer Bindungsbrüche statt.
- Wenn ein Wasserstoffatom durch ein Chlorradikal von dem Methanmolekül abgetrennt wird, so dass ein Methanradikal und HCl entsteht, muss Energie aufgewendet werden. Die Reaktion ist endotherm. Dies kommt dadurch zustande, weil die Kohlenstoff-Wasserstoff-Bindung eine höhere Bindungsenergie besitzt als die Wasserstoff-Chlor-Bindung. Die Aufspaltung der Kohlenstoff-Wasserstoff-Bindung ist eine Barriere (der erste hohe Berg im Diagramm), welche nicht wieder wett gemacht werden kann.
- Ein Methanradikal benötigt auch Energie, um die Chlor-Chlor-Bindung zu spalten. Dies ist die zweite Barriere (der zweite kleinere Berg im Diagramm). Bei der Kohlenstoff-Chlor-Verbindung entsteht eine erhebliche Menge an Energie, weshalb nun eine exotherm Reaktion stattfindet.
- Die Gesamtenergiebilanz ist negativ, weshalb die Reaktion exotherm ist und ist sie auch einmal gestartet, bis zum Schluss abläuft.