Silizium Unterabschnitte
Während man Kohlenstoff als den ,,Träger des organischen Lebens'' bezeichnen kann, da er in fast allen organischen Verbindungen eine entscheidende Rolle spielt und für das organische Leben nicht wegdenkbar ist, kann man Silizium als den ,,Träger des anorganischen Lebens'' bezeichnen, wobei anorganische Stoffe gar nicht leben.
Silizium kommt vor allen in 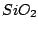 vor. Dies ist einfacher Sand und ist überall auf der Erde zu finden. Aber nicht nur in Sand, sondern auch in Slikaten ist Silizium eingebaut. Man kann Silizium mit folgender Reaktion darstellen: vor. Dies ist einfacher Sand und ist überall auf der Erde zu finden. Aber nicht nur in Sand, sondern auch in Slikaten ist Silizium eingebaut. Man kann Silizium mit folgender Reaktion darstellen:
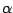 -Si ist die normale Modifikation. Sie kristallisiert wie Kohlenstoff in Diamantstruktur aus, weshalb Silizium spröde ist. Silizium ist ein Halbleiter, welcher durch Dotierung aktiviert werden kann. -Si ist die normale Modifikation. Sie kristallisiert wie Kohlenstoff in Diamantstruktur aus, weshalb Silizium spröde ist. Silizium ist ein Halbleiter, welcher durch Dotierung aktiviert werden kann.
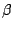 -Si ist die Hochdruckmodifikation.
Ist von geringer Bedeutung. Es ist sehr kurzlebig und entsteht bei hohen Temperaturen durch Erhitzen von -Si ist die Hochdruckmodifikation.
Ist von geringer Bedeutung. Es ist sehr kurzlebig und entsteht bei hohen Temperaturen durch Erhitzen von 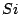 mit mit 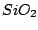 : :
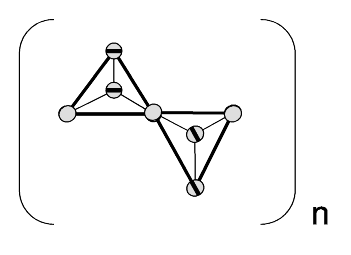
Durch Abschrecken erhält man polymeres 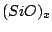 , welches man durch ein , welches man durch ein 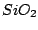 -Netz schützen kann.
Anders als -Netz schützen kann.
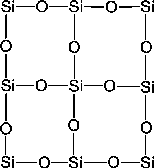
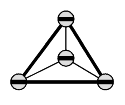
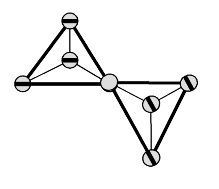
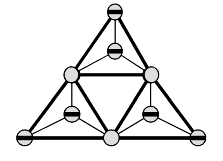
Anders als 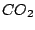 ist Siliziumdioxid polymer. Es kristallisiert aus. Jedes Siliziumatom ist mit vier Sauerstoffatomen tetraedisch verbunden, von denen zwei von ihm selbst kommen. Planare Sicht: ist Siliziumdioxid polymer. Es kristallisiert aus. Jedes Siliziumatom ist mit vier Sauerstoffatomen tetraedisch verbunden, von denen zwei von ihm selbst kommen. Planare Sicht:
Siliziumdioxid kommt außer dem noch in einigen anderen Modifikationen vor:
| Modifikation |
Temperatur |
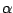 -Quarz -Quarz |
bis 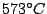 |
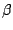 -Quarz -Quarz |
bis 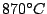 |
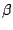 -Tridymit -Tridymit |
bis 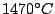 |
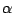 -Tridymit -Tridymit |
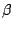 -Tridymit ist die Form, welche bei niedrigen Temperaturen bevorzugt vorliegt. Bei hohen Temperaturen trifft man -Tridymit ist die Form, welche bei niedrigen Temperaturen bevorzugt vorliegt. Bei hohen Temperaturen trifft man 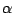 -Tridymit an. Kühlt man -Tridymit an. Kühlt man 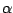 -Tridymit ab, so wird es wieder zu -Tridymit ab, so wird es wieder zu 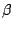 -Tridymit. Da bei diesem Wechsel nur interne Strukturen gerändert werden und keine Bindungen gespalten und neu gebildet werden müssen, verläuft die Rückführung sogar bei relativ niedrigen Temperaturen von -Tridymit. Da bei diesem Wechsel nur interne Strukturen gerändert werden und keine Bindungen gespalten und neu gebildet werden müssen, verläuft die Rückführung sogar bei relativ niedrigen Temperaturen von 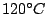 . Wird diese Temperatur unterschritten, so bleibt . Wird diese Temperatur unterschritten, so bleibt 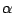 -Tridymit metastabil bestehen. -Tridymit metastabil bestehen. |
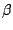 -Cristobalit -Cristobalit |
bis 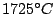 |
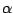 -Cristobalit -Cristobalit |
Kann ähnlich wie 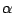 -Tridymit bei niedrigen Temperaturen von -Tridymit bei niedrigen Temperaturen von 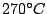 in in 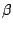 -Cristobalit wechseln. Darunter metastabil. -Cristobalit wechseln. Darunter metastabil. |
| Schmelze |
über 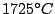 |
| Glas |
Schreckt man die Schmelze ab, so hat 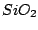 keine Zeit zuerst zu Cristobalit zu werden und dann über Tridymit zu Quarz zu werden, sondern es kristallisiert teilweise aus und bildet Glas. Glas ist bei moderaten Temperaturen metastabil. Es besitzt eine Nahordnung aus keine Zeit zuerst zu Cristobalit zu werden und dann über Tridymit zu Quarz zu werden, sondern es kristallisiert teilweise aus und bildet Glas. Glas ist bei moderaten Temperaturen metastabil. Es besitzt eine Nahordnung aus 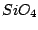 -Tetraedern aber keine Fernordnung. -Tetraedern aber keine Fernordnung. |
Siliziumdioxid ist sehr beständig. Es wird nur durch Flußsäure oder geschmolzene Alkalihydroxide angegriffen:
Verwendung findet das Siliziumdioxid in Silikonen, die zu den siliziumorganischen Verbindungen zählen.
Silikone können beispielsweise als Dicht- und Dämmmaterial genutzt werden; in flüssiger Form allerdings auch als Bestandteile von Kosmetik und Salben.
Gläser kann man Färben, indem man bestimmte Zusatzstoffe beimischt. Man kann sie auch ganz blind machen, indem man wieder andere Stoffe beimischt.
Silicate sind aus 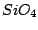 -Tetraedern aufgebaut. Sie sind die Salze der Kieselsäure und treten sehr häufig auf der Erdkruste auf. -Tetraedern aufgebaut. Sie sind die Salze der Kieselsäure und treten sehr häufig auf der Erdkruste auf.
Jedes Eckensauerstoffatom, welches nur an ein einziges Siliziumatom gebunden ist, trägt eine negative Ladung. Deshalb sind Silicate Makroanionen. Dazu gehören Kationen, die sich manchmal auch in deren Lücken setzen.
Einige Silicatgitter:
| Struktur |
Beschreibung |
| Insel |
![$[SiO_{4}]^{4-}$](img395.png)
|
| Gruppen |
z.B.
![$[Si_{2}O_{7}]^{6-}$](img396.png)
|
| Ring |
z.B.
![$[Si_{3}O_{9}]^{6-}$](img397.png)
|
| Ketten |
![$\left[[Si_{}O_{3}]^{2-}\right]_{n}$](img398.png)
|
| Band |
Eindimensional (d.h. nur eine Kette) aneinandergekettete Ringsilikate |
| Schicht |
Zweidimensional (d.h. eine Fläche) verbundene Ringsilikate oder Gruppensilikate |
| Gerüst |
Gerüstsilikate haben eine dreidimensionale Struktur. Wie in 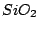 sind die Tetraeder an allen vier Ecken verbunden. Ganz besonders interessant sind die Zeolithe. Es sind dreidimensinale Silicate mit Hohlräumen, welche durch Kanäle verbunden sind. Zeolithe werden wegen der hohen inneren Oberfläche gerne als Kathalysator verwendet. Außerdem haben sie eine enorme Bedeutung in Waschmitteln, da sie die permanente Wasserhärte durch Ionenaustausch verringern können. sind die Tetraeder an allen vier Ecken verbunden. Ganz besonders interessant sind die Zeolithe. Es sind dreidimensinale Silicate mit Hohlräumen, welche durch Kanäle verbunden sind. Zeolithe werden wegen der hohen inneren Oberfläche gerne als Kathalysator verwendet. Außerdem haben sie eine enorme Bedeutung in Waschmitteln, da sie die permanente Wasserhärte durch Ionenaustausch verringern können.
|
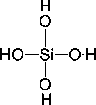
Monokieselsäure 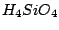 ist eine schwache vierbasige Säure: ist eine schwache vierbasige Säure:
Sie neigt noch stärker als Phosphorsäure zur Wasserabspaltung, so daß sie nur in sehr geringen Konzentrationen beständig ist. Sie bildet sich automatisch, wenn in der Natur Wasser auf 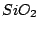 fällt fällt
Sie kann aus Wasserglas unter Zusatz von Salzsäure hergestellt werden. Wasserglas ist eine Lösung eines Silikates z.B. Natriumsilikat 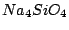
Die Monokieselsäure spaltet sofort Wasser ab und wird zu Kieselgel, welches schnell fest wird und nach und nach zu 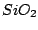 wird.
Die Wasserstoffverbindungen des Siliziums ähneln den Wasserstoffverbindungen des Kohlenstoffs. Die Alkane mit Kohlenstoff sind mit Silizium Catena-Silane. Methan mit Silizum hat den Namen Monosilan. Zykloalkane sind zylische Silane. Silane sind endotherme Verbindungen, in denen der Wasserstoff eine negative!! Partialladung hat. Sie reagieren heftig mit Wasser unter Bildung von Kieselsäuren: wird.
Die Wasserstoffverbindungen des Siliziums ähneln den Wasserstoffverbindungen des Kohlenstoffs. Die Alkane mit Kohlenstoff sind mit Silizium Catena-Silane. Methan mit Silizum hat den Namen Monosilan. Zykloalkane sind zylische Silane. Silane sind endotherme Verbindungen, in denen der Wasserstoff eine negative!! Partialladung hat. Sie reagieren heftig mit Wasser unter Bildung von Kieselsäuren:
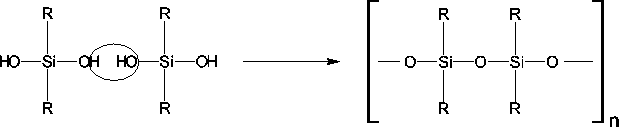
Silicone bestehen aus Silanolverbindungen. Diese sind Derivate der Kieselsäure. In ihnen werden zwei oder drei OH-Gruppen durch Alkylreste ausgetauscht. Wird Wasser abgespalten, so bilden diese Silane Ketten, die man als Silicon kennt:
Zur Herstellung von Silanen wird zuerst Silziumtetrachlorid mit Alylresten gebunden z.B. an Lithium alkyliert
und danach zu 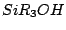 und und
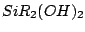 hydrolisiert. hydrolisiert.
|