Sauerstoff Unterabschnitte
SauerstoffDarstellung: LindeverfahrenIm Lindeverfahren wird die Luft verflüssigt, indem sie auf niedrige Temperaturen gebracht wird, um sie danach zu destillieren. Dies geschieht mit dem Luftverflüssiger, indem zuerst Luft komprimiert wird. Dadurch wird Wärme frei, welche durch einen Kühler abgeleitet wird. Danach wird die Luft wieder expandiert und pro Bar um etwaSauerstoff hat einen ähnlichen Siedepunkt wie Stickstoff. Der Siedepunkt von Stickstoff ist jedoch etwas geringer. Deshalb muß das Gemisch mehrfach destilliert werden, um reinen Sauerstoff zu erhalten. 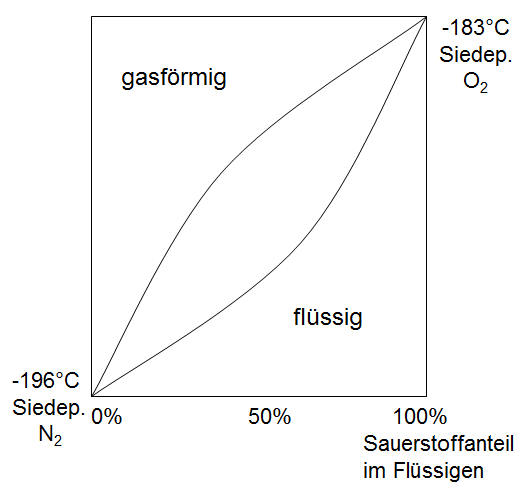
Darstellung: BaOVor dem Lindeverfahren konnte man Sauerstoff nur mit Hilfe vonDes weiteren kann Sauerstoff auch mit Darstellung: Elektrolyse von KalilaugeSauerstoff kann man durch Elektrolyse von Kalilauge oder Natriumlauge gewinnen. Hierbei werden dieSingulett und TrippletsauerstoffDer normale Zustand des Sauerstoffmoleküls ist der Trippletzustand, auch Trippletsauerstoff genanntStehen sie jedoch entgegengesetzt oder sind sie sogar in demselben antibindenen Trippletsauerstoff ist blau, Singulettsauerstoff rot. Singulettsauerstoff ist sehr reaktiv und ist die bleichende Reagenz beim Bleichen mit Sauerstoff. Durch Stöße von zwei Singulettsauerstoffmolekülen reagiert dieser jedoch wieder zu Trippletsauerstoff. Herstellung von SinguletsauerstoffSinguletsauerstoffLänge der Doppelbindung bei Sauerstoff in IonenSauerstoff kann einfach positiv wie bis zu zweifach negativ geladen sein. Je mehr Ladung das Sauerstoffmolekül oder Ion hat, desto länger ist die Bindung. Grund hierfür ist die Abstoßung der Elektronen.Bei negativen Ionenladungen werden die zusätzlichen Elektronen in das antibindende Orbital mit aufgefüllt. OzonOzon stellt man mit einem siemensschen Ozonisator herOzon zersetzt sich wieder leicht. Es ist eine stark oxidierende Substanz und hat fast so eine große Oxidationswirkung wie Sauerstoff in atomarer Form. In der Atmosphäre wird Ozon dazu gebraucht, um die UV-Strahlung aus dem Weltall zu filtern. Es entsteht durch UV-Strahlung, filtert diese aber auch. Jedoch wird es durch Fluorchlorkohlenwasserstoffe zerstört, weil diese Radikale bilden, welche die Ozon verfügt über ein delokalisiertes Elektronenpaar in der |