Phosphor Unterabschnitte
Phosphor kann man aus Calciumphosphat gewinnen:
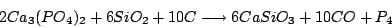
Phosphor existiert in vielen unterschiedlichen Modifiaktionen:
| Modifikation |
Beschreibung |
| weißer Phosphor |
entsteht bei der Kondensation von Phosphordampf, er besteht aus 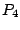 -Molekülen, ist sehr reaktiv und giftig, weißer Phosphor ist wachsweich und oxidiert spontan mit dem Luftsauerstoff (dazu später mehr) -Molekülen, ist sehr reaktiv und giftig, weißer Phosphor ist wachsweich und oxidiert spontan mit dem Luftsauerstoff (dazu später mehr) |
| roter Phosphor |
entsteht beim Erhitzen von weißen Phosphor unter Luftabschluß auf
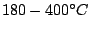 . Ist ein unregelmäßiges dreidimensionales Netzwerk. Roter Phosphor ist luftstabil und ungiftig. Er wird in Zündhölzern verwendet. Es reagiert erst bei Temperaturen von . Ist ein unregelmäßiges dreidimensionales Netzwerk. Roter Phosphor ist luftstabil und ungiftig. Er wird in Zündhölzern verwendet. Es reagiert erst bei Temperaturen von 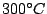 . . |
| violetter Phosphor |
entsteht beim weiteren Erwärmen von rotem Phosphor auf 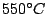 oder beim Erwärmen von schwarzem Phosphor auf oder beim Erwärmen von schwarzem Phosphor auf 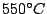 . Kristalliert in einer komplizierten Schichtstruktur . Kristalliert in einer komplizierten Schichtstruktur |
| Phosphordampf |
Bei 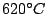 sublimiert Phosphor. Phosphordampf besteht aus sublimiert Phosphor. Phosphordampf besteht aus 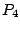 -Molekülen, die hochreaktiv sind. Durch Abschrecken bekommt man weißen Phosphor. -Molekülen, die hochreaktiv sind. Durch Abschrecken bekommt man weißen Phosphor. |
| schwarzer Phosphor |
Ist die Hochdruckmodifikation. Herstellung bei 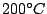 und und 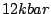 oder bei oder bei 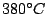 unter Anwesenheit von Quecksilber. Er ist ein Halbleiter und stabil bis unter Anwesenheit von Quecksilber. Er ist ein Halbleiter und stabil bis 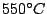 . . |
| rhomboedrischer Phosphor |
Entsteht aus schwarzem Phosphor unter 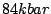 . Er kristallisiert rhomboedirsch. . Er kristallisiert rhomboedirsch. |
| kubischer Phosphor |
Entsteht aus rhomboedrischen Phosphor bei 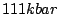 . . |
Im Dunkeln leuchtet weißer Phosphor. Er reagiert mit dem Luftsauerstoff zu 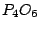 und sublimiert. Danach reagiert er weiter mit dem Luftsauerstoff zu und sublimiert. Danach reagiert er weiter mit dem Luftsauerstoff zu 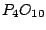 . Die entstandene Energie wird nicht in Form von Wärme abgegeben, sondern in Form von Licht. Deshalb leuchtet weißer Phosphor im Dunkeln. . Die entstandene Energie wird nicht in Form von Wärme abgegeben, sondern in Form von Licht. Deshalb leuchtet weißer Phosphor im Dunkeln.
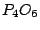 (Phosphor(III)-Oxid): (Phosphor(III)-Oxid):
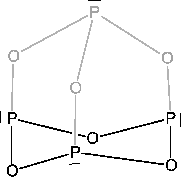
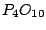 (Phosphor(V)-Oxid): (Phosphor(V)-Oxid):
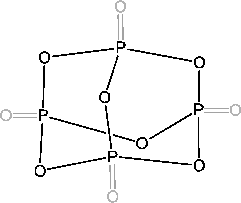
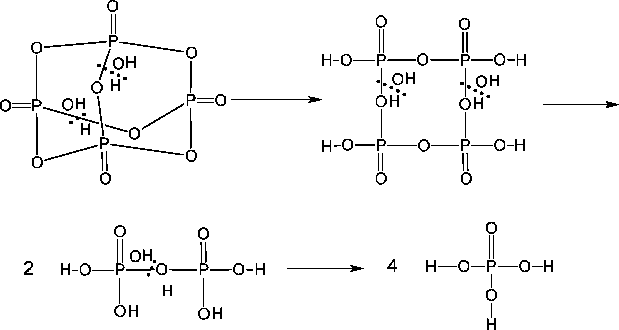
Phosphor(V)-Oxid wirkt stark wasserentziehend. Beim Erwärmen bildet es Polymere, die zuerst in Schichten vorhanden sind und danach eine dreidimensionale Struktur haben.
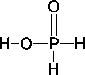
Phosphinsäure (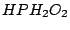 ): Oxidationszahl ): Oxidationszahl 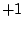
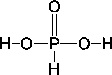
Phosphonsäure (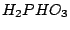 ): Oxidationszahl ): Oxidationszahl 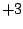
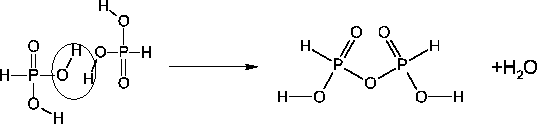
Phosphonsäure kann unter Wasserabspaltung Polymere bilden, zum Beispiel die Diphosphonsäure (
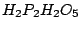 ): ):
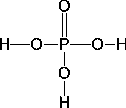
Ortho-Phosphorsäure (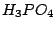 ): Oxidationszahl ): Oxidationszahl 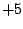
Das Phosphation 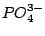 ist tetraedisch. Alle Bindungen sind gleichwertig. Dies läßt sich als ein ist tetraedisch. Alle Bindungen sind gleichwertig. Dies läßt sich als ein 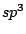 -Hybridorbital mit einer delokalisierten (d-p) -Hybridorbital mit einer delokalisierten (d-p)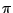 -Bindung deuten. -Bindung deuten.
Orthophosphorsäure bildet wieder Polymere, so wie es die Phosphonsäure schon getan hat. Es entstehen Ketten, Verzweigungen und Gitter.
Darstellung: Orthophosphorsäure erhält man, indem man 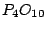 hydratisiert: hydratisiert:
Darstellung auf nassem Wege:
Orthophosporsäure bildet drei Reihen von Salzen, da sie dreiwertig ist:
| Anzahl der Metallatome |
Name |
Beispiel |
| 1 |
Dihydrogenphosphate (primäre Phosphate) |
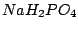 |
| 2 |
Hydrogenphosphate (sekundäre Phosphate) |
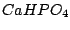 |
| 3 |
Orthophosphate (tertiäre Phosphate) |
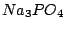 |
Anders als Stickstoff verfügt Phosphor über d-Orbitale. Eine (p-d)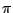 -Bindung wird vor einer (p-p) -Bindung wird vor einer (p-p)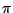 -Bindung bevorzugt. Deshalb neigt Phosphor zur Bildung von Polymeren.
Zur Düngung wird häufig phosphathaltige Dünger eingesetzt. Natürliches -Bindung bevorzugt. Deshalb neigt Phosphor zur Bildung von Polymeren.
Zur Düngung wird häufig phosphathaltige Dünger eingesetzt. Natürliches
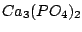 ist unlöslich und muß in eine lösliche Verbindung umgewandelt werden. Dies geschieht mit Schwefelsäure: ist unlöslich und muß in eine lösliche Verbindung umgewandelt werden. Dies geschieht mit Schwefelsäure:
Diesen Dünger nennt man ,,Superphosphat''.
Calciumcarbonat wird jedoch nicht umgewandelt. Man kann auch dieses Umwandeln, indem man 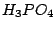 als Säure verwendet: als Säure verwendet:
Phosphor kann mit Halogenen in Verbindung treten. Hierbei können unterschiedliche Anzahlen von Phosphoratomen und Halogenatomen vorkommen.
|