Stickstoff Unterabschnitte
Ähnlich wie Sauerstoff kann man Stickstoff durch fraktionierende Destillation der Luft isolieren. Stickstoff ist der Hauptbestandteil der Luft und kommt in ihr in einem Anteil von 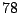 Prozent (Volumenprozent) vor.
Stickstoff kann man im Labor auf verschiedene Weise herstellen. Hier einige Beispiele: Prozent (Volumenprozent) vor.
Stickstoff kann man im Labor auf verschiedene Weise herstellen. Hier einige Beispiele:
Ammoniak 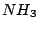 ist ein farbloses und stechend riechendes Gas. Es läßt sich ähnlich wie Chlor leicht verflüssigen. Im Ammoniak gibt es ähnlich wie beim Wasser eine Autoprotolyse: ist ein farbloses und stechend riechendes Gas. Es läßt sich ähnlich wie Chlor leicht verflüssigen. Im Ammoniak gibt es ähnlich wie beim Wasser eine Autoprotolyse:
In Wasser reagiert Ammoniak leicht basisch:
Versetzt man Calcium mit Ammoniak so bildet sich Calciumdiamid
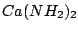 und Wasserstoff. Erwärmt man dieses, so bildet sich Calciumimid unter Freisetzung von Ammoniak und schließlich Calciumnitrid unter nochmaliger Freisetzung von Ammoniak. Versetzt man Amide, Imide oder Nitride mit Wasser, so bildet sich sofort Ammoniak. und Wasserstoff. Erwärmt man dieses, so bildet sich Calciumimid unter Freisetzung von Ammoniak und schließlich Calciumnitrid unter nochmaliger Freisetzung von Ammoniak. Versetzt man Amide, Imide oder Nitride mit Wasser, so bildet sich sofort Ammoniak.
Im Haber-Bosch-Verfahren wird der Luftstickstoff mit Wasserstoff zur Reaktion gebracht. Dies funktioniert nur unter Druck, da das Gleichgewicht der Reaktion unter Raumtemperatur zwar auf der Produktseite liegt, die Reaktion aber zu langsam abläuft und bei höheren Temperaturen die Reaktion zwar abläuft, aber das Gleichgewicht auf die Eduktseite geht. Es wird mit Drücken um die 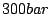 und Temperaturen um und Temperaturen um
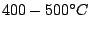 gearbeitet. gearbeitet.
Dabei wird noch ein Kontaktkatalysator eingesetzt. Es ist 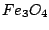 . Dieser wird bei den vorhandenen Temperaturen durch den vorhandenen Wasserstoff zu . Dieser wird bei den vorhandenen Temperaturen durch den vorhandenen Wasserstoff zu 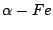 reduziert. Zum Eisen gibt es auch noch einige Beigaben. Wasserstoff und Stickstoffatome lagern sich auf dem reduziert. Zum Eisen gibt es auch noch einige Beigaben. Wasserstoff und Stickstoffatome lagern sich auf dem 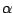 -Eisen an und reagieren zu -Eisen an und reagieren zu 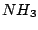 . .
Im Labor kann man Ammoniak wie folgt darstellen:
Hydrazin ist eine endotherme Verbindung. Beim Erwärmen zersetzt sich die Flüssigkeit explosiv. Es löst sich quasi unbegrenzt in Wasser. Wässrige Lösungen sind gefahrlos handhabbar. Verbrennt man sie mit Sauerstoff, entsteht viel Wärme, weshalb sie gerne als Raketentreibstoff verwendet wird.
Hydranzin kann man mit der Rasching-Synthese erzeugen:
Ist wieder eine explosive Flüssigkeit. Die Salze heißen Azide. Schwermetallazide sind hochexplosiv. In gelöster Form jedoch nicht.
Stickstoffmonoxid ist ein farbloses und giftiges Gas. Es entsteht unter hohen Temperaturen aus Luftstickstoff und Luftsauerstoff:
Man kann Stickstoffmonoxid abschrecken und es bleibt auch bei Raumtemperatur im metastabilen Zustand.
Großtechnisch läßt sich Stickstoffmonoxid mit dem Ostwald-Verfahren herstellen. Dabei wird Ammoniak und Sauerstoff über heißes Platinblech geleitet:
Die Kontaktzeit ist sehr gering. 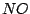 wird somit abgeschreckt und ist metastabil. Das Ostwald-Verfahren ist ein wichtiger Schritt in der Salpetersäuresynthese. wird somit abgeschreckt und ist metastabil. Das Ostwald-Verfahren ist ein wichtiger Schritt in der Salpetersäuresynthese.
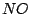 dimerisiert: dimerisiert:
Auch Stickstoffmonoxid und Stickstoffdioxid können gemeinsam dimerisieren, wobei Distickstoffoxid entsteht, welches eine blaue Flüssigkeit bei niedrigen Temperaturen ist.
Es reagiert spontan mit Sauerstoff (bei hohen Temperaturen liegt das Gleichgewicht auf der Eduktseite):
Stickstoffdioxid neigt wieder zu Dimerisierung
Es ist ein Oxidationsmittel.
Salpetrige Säure ist nicht rein isolierbar und ist auch im wässrigen unbeständig. Sie disproportioniert:
Salpetersäure ist beständiger als salpetrige Säure. Jedoch zersetzt sie sich auch bei Lichteinwirkung schon bei Raumtemperatur. Salpetersäure ist ein starkes Oxidationsmittel.
Die Herstellung von Salpetersäure verläuft wie folgt:
- Wir erhalten
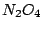 , indem wir das aus dem Ostwaldverfahren gewonnene , indem wir das aus dem Ostwaldverfahren gewonnene 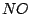 oxidieren: oxidieren:
- Dieses leiten wir in Wasser. Es passiert folgendes:
- Salpetrige Säure zerfällt wieder (s.o.)
- Mit dem entstandenen
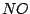 starten wir wieder bei 1. starten wir wieder bei 1.
| Struktur |
Fluor |
Chlor |
Brom |
Iod |
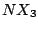 , tetraedisch , tetraedisch |
farbloses Gas |
gelbes explosives Öl |
rote exlosive Kristalle |
rotschwarze explosive Kristalle |
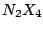 Struktur wie Hydrazin Struktur wie Hydrazin |
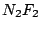 farbloses Gas farbloses Gas |
- |
- |
- |
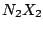 Mittig zwei N-Atome, Halogenatome gewinkelt, es existiert eine cis und eine trans Struktur Mittig zwei N-Atome, Halogenatome gewinkelt, es existiert eine cis und eine trans Struktur |
farbloses Gas |
- |
- |
- |
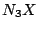 , Struktur wie , Struktur wie 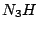 |
grüngelbes Gas |
farbloses Gas, explosiv |
orangrote Flüssigkeit, explosiv |
farbloser Feststoff, explosiv |
|