Sauerstoffsäuren des Chlors Unterabschnitte
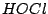 |
Oxidationszahl: 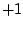 |
schwache Säure, starkes Oxidationsmittel |
Hypochlorige Säure sieht wie folgt aus bzw. kann wie folgt in Proton und Anion zerlegt werden:
Sie entsteht durch Einleiten von 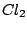 in Wasser: in Wasser:
Die Reaktion ist ein chemisches Gleichgewicht. Nach dem Prinzip von Le Chatelier kann man jedoch 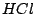 mit mit 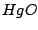 fällen, womit man das System anregt fällen, womit man das System anregt 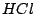 nachzuproduzieren, wobei auch nachzuproduzieren, wobei auch 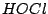 produziert wird. produziert wird.
Wenn man Hypochlorid und Salzsäure zusammenbringt, reagieren diese zu Wasser und Chlor. Das Chlor entweicht. Dieses Problem tritt bei Toilettenreinigungsmitteln auf, da chlorhaltige Mittel Hypochlorid enthalten und andere wieder Säure.
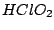 |
Oxidationszahl: 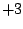 |
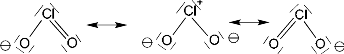
Chlorige Säure ist instabil und hat deshalb keine praktische Bedeutung. Das Anion der Chlorigen Säure ist v-förmig gewinkelt. Es existieren drei mesomere Grenzstrukturen (Dies ist nicht nur bei dieser Säure so, sondern es ist auch bei der Chlorsäure und Perchlorsäure so. Dort existieren sogar noch mehr Grenzformeln):
Herstellung dieser Säure mit Hilfe von Barriumdichlorit:
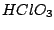 |
Oxidationszahl: 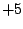 |
starke Säure, starkes Oxidationsmittel |
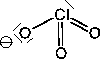
Das Anion der Chlorsäure ist pyramedial. Es existieren 4 mesomere Grenzstrukturen:
Chlorsäure entsteht durch Übersäuern von Hypochloriger Säure:
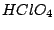 |
Oxidationszahl: 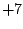 |
stärkste Säure
(jedoch weniger oxidierend aus kinetischen Gründen) |
Perchlorsäure ist als die einzigste Säure rein darstellbar. D.h. sie existiert nicht nur im gelösten Zustand, sondern ist auch in fester Form vorhanden. Allerdings reagiert eingetrocknete Perchlorsäure schon auf Erschütterungen explosionsartig. Mit verdünnten Perchlorsäuren ist also äußerste Vorsicht geboten, daß diese nicht in Fugen tropfen, wo sie eintropfen und später explodieren können.
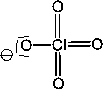
Das Anion der Perchlorsäure ist tetraedisch:
Darstellung (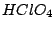 kann abdestilliert werden): kann abdestilliert werden):
|