Unterabschnitte
Variiert man die thermodynamischen Parameter (z. B. Druck, Temperatur,
Volumen, Zusammensetzung) einer Stoffmischung oder eines Reinstoffes, so
findet man, dass im Gleichgewicht unterschiedliche Phasen auftreten. Als
Phasen bezeichnet man die homogenen Bereiche in der Probe, die jeweils
gleichartig sind, d. h. die gleichen physikalischen Eigenschaften haben.
So treten in Reinstoffen in der Regel mindestens Feststoff, Flüssigkeit
und Dampf als Phasen auf. Es gibt aber auch Reinstoffe, die mehrere
feste Phasen bilden können, z. B. Kohlenstoff mit Graphit und Diamant.
Diagramme, in denen zwei thermodynamische Größen gegeneinander
aufgetragen sind, und in denen durch Kurven die Stabilitätsbereiche der
auftretenden Phasen markiert sind, nennt man Phasendiagramme. Für
Reinstoffe sind zwei Phasendiagramme üblich. Am häufigsten findet man
das p-T-Diagramm, seltener ist das T-V_m-Diagramm (V_m ist das
Molvolumen). Für Zweistoffsysteme ist das X-T-Diagramm üblich (X ist der
molare Anteil der einen Komponente, oft in Molprozent angegeben).
In einem Zustandsdiagramm mit drei unterschiedlichen Phasen
eines Reinstoffes gibt es zwei markante Punkte und
drei Kurven:
- Tripelpunkt: Der Punkt, durch Druck und Temperatur (also ohne einen weiteren Freiheitsgrad festgelegt) an welchem Gas, Flüssigkeit und Feststoff gleichzeitig vorliegen, wird Tripelpunkt genannt. Der Tripelpunkt heiüt Tripelpunkt, weil dort ein Tripel (eine "Dreiheit") von Phasen vorliegt. Es sind auch Tripelpunkte bekannt, in denen zwei feste und eine flüssige Phase oder drei feste Phasen miteinander im Gleichgewicht stehen.
- kritischer Punkt: Der Punkt, an welchem es keine flüssige Phase, sondern nur noch eine gasförmige mehr gibt wird kritischer Punkt genannt. Die flüssige Phase geht (,,wabert'') an diesem Punkt in eine einzige gasförmige Phase über. Auch bei hohen Drücken kann man jenseits des kritischen Punktes kein Gas mehr zur Flüssigkeit machen.
Der kritische Punkt ist der Zustand, in dem die beiden fluiden Phasen (Flüssigkeit und Gas) in ihren Eigenschaften übereinstimmen, also nicht mehr unterscheidbar sind. Man kann in diesem Punkt daher nicht mehr von zwei Phasen sprechen. Es gibt gute Argumente dafür, dass sich die "Löcher" in einer Flüssigkeit (Lücken zwischen den Molekülen) ähnlich verhalten wie die Moleküle im Dampf. Man kann daher die Flüssigkeit auch wie einen Dampf aus "Lückenteilchen" beschreiben. Bei Annäherung an den kritischen Punkt entstehen immer mehr Lücken (die Dichte der Flüssigkeit sinkt), und andererseits verdampfen immer mehr Teilchen (Gasdichte steigt). Irgendwann erreicht man einen Zustand, in dem die Flüssigkeit zur Hälfte aus Lücken und der Dampf zur Hälfte aus Teilchen besteht, und beide dieselbe Dichte besitzen. Wenn man nun darüber nachdenkt, woraus die beiden jeweils anderen Hälften bestehen, sieht man, dass beide Phasen gleich geworden sind. Das Modell von Van-der-Waals lässt sich in dieser Weise deuten.
- Auf jeder Kurve gibt es einen Freiheitsgrad. Man kann Temperatur ändern und den Druck anpassen und man bleibt auf der Kurve oder umgekehrt.
- Sublimationskurve: Die Subslimationskurve ist die Kurve zwischen festem und gasförmigem Zustand.
- Schmelzkurve: Kurve zwischen festen und flüssigen Zustand
- Dampfdruckkurve: Kurve zwischen flüssigem und gasförmigem Zustand.
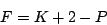
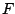 : Freiheitsgrade, : Freiheitsgrade, 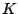 :Komponenten1, :Komponenten1, 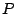 :Phasen2
Anzahl der maximalen Phasen 3, Anzahl der Komponenten 1 :Phasen2
Anzahl der maximalen Phasen 3, Anzahl der Komponenten 1
- Am Tripelpunkt ist die Anzahl der Phasen drei, folglich gilt
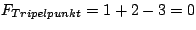 . Es gibt keine Freiheitsgrade. Weder Druck noch Temperatur darf variiert werden. . Es gibt keine Freiheitsgrade. Weder Druck noch Temperatur darf variiert werden.
- Auf einer Kurve ist die Anzahl der Phasen zwei, folglich gilt
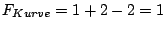 . Ein Wert darf variiert werden, während der andere angepaßt wird. (s.o.) . Ein Wert darf variiert werden, während der andere angepaßt wird. (s.o.)
- In einer Phase ist die Anzahl der Phasen eine. Man kann in Druck und Temparatur in gewissem Maße variieren und bleibt immer noch in der Phase.
- In einer Lösung kommt eine Komponente hinzu, während es immer noch drei Phasen gibt. Die Anzahl der Freiheitsgrade kann dabei bis auf 3 steigen. Man bräuchte ein dreidimensionales Bild, um das Zustandsdiagramm komplett zu zeichnen.
Dieses p-T-Zustandsdiagramm ist ein Standarddiagramm, welches für viele Stoffe ähnicher Natur ist
x-Achse: Temperatur
 y-Achse: Druck
Wasser hat eine Anomalie. Die Schmelzkurve kippt statt nach vorne nach hinten. Deshalb kann man auf Wasser-Eis Schlittschuhlaufen, da Wasser-Eis bei hohen Drücken flüssig wird. Auf y-Achse: Druck
Wasser hat eine Anomalie. Die Schmelzkurve kippt statt nach vorne nach hinten. Deshalb kann man auf Wasser-Eis Schlittschuhlaufen, da Wasser-Eis bei hohen Drücken flüssig wird. Auf 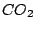 -Eis wäre dies nicht möglich. Diese Annomalie existiert wegen der Wasserstoffbrückenbindungen. -Eis wäre dies nicht möglich. Diese Annomalie existiert wegen der Wasserstoffbrückenbindungen.
Die Phasen von Stoffen werden dann wichtig, wenn Gase komprimiert werden. Ein komprimiertes Gas in flüssiger Form nimmt viel weniger Raum als im gasförmigen Zustand ein.
Wenn Gase komprimiert werden, so steigt ihre Dichte. Mit einem Membrankompressor lassen sich unter anderem Gase wie Helium, Argon, Chlor oder Wasserstoff verdichten, indem sie zusammengepresst werden. Dadurch erhöht sich im Inneren des Kompressors die Dichte des entsprechenden Gases. Oftmals werden derlei Verdichter oder Kompressoren bei hochreinen Anwendung eingesetzt, da sie leckagefrei arbeiten. Verwendet werden Membrankompressoren beispielsweise bei der Befüllung von Vorratsbehältern oder bei der Einspeisung von Gasen in fortlaufende Prozesse.
|
