Schwefel Unterabschnitte
 Schwefel kommt sowohl elementar, als auch im sauren Erdgas als
Schwefel kommt sowohl elementar, als auch im sauren Erdgas als 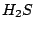 vor. Des weiteren findet man ihn auch in verschiedenen Sulfiden und Sulfaten in der Natur: vor. Des weiteren findet man ihn auch in verschiedenen Sulfiden und Sulfaten in der Natur:
| Sulfide |
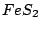 (Eisenkies, Pyrit) (Eisenkies, Pyrit) |
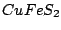 (Kupferkies) (Kupferkies) |
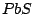 (Bleiglanz) (Bleiglanz) |
| Sulfite |
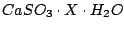 (Calciumsulfit) (Calciumsulfit) |
| Sulfate |
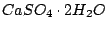 (Gips) (Gips) |
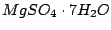 (Bittersalz) (Bittersalz) |
Schwefelwasserstoff 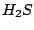 aus dem sauren Erdgas oder von einer anderen Quelle her gewonnen wird mit Sauerstoff verbrannt. Das entstehende Schwefeldioxid reagiert noch einmal mit Schwefelwasserstoff zu Schwefel und Wasser. Bei der Schwefelherstellung auf diese Weise ist darauf zu achten, daß in der Brennkammer nicht zuviel Sauerstoff ist. Sonst reagiert Schwefelwasserstoff mit diesem vollständig und es ist kein Schwefelwasserstoff mehr vorhanden, um die zweite Reaktion durchzuführen: aus dem sauren Erdgas oder von einer anderen Quelle her gewonnen wird mit Sauerstoff verbrannt. Das entstehende Schwefeldioxid reagiert noch einmal mit Schwefelwasserstoff zu Schwefel und Wasser. Bei der Schwefelherstellung auf diese Weise ist darauf zu achten, daß in der Brennkammer nicht zuviel Sauerstoff ist. Sonst reagiert Schwefelwasserstoff mit diesem vollständig und es ist kein Schwefelwasserstoff mehr vorhanden, um die zweite Reaktion durchzuführen:
-
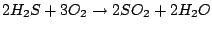
- Bei
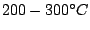 : :
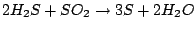
Beim Fraschverfahren wird elementarer Schwefel mit Hilfe von heißem Wasserdampf aus schwefelhaltigen Schichten geschmolzen und unter Druck zu Tage gefördert. Dies funktioniert, weil Schwefel einen relativ niedrigen Schmelzpunkt hat. Der geförderte Schwefel ist bereits sehr rein.
Schwefel besteht in vielen Modifikationen aus 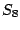 -Ringen. Diese sind besonders stabil. Diese Ringe haben eine Form wie eine Krone, welche durch die Hybridisierung der -Ringen. Diese sind besonders stabil. Diese Ringe haben eine Form wie eine Krone, welche durch die Hybridisierung der 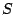 -Atome zustande kommt. -Atome zustande kommt.
| Modifikation |
Temperatur |
Beschreibung |
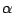 -S -S |
bis 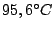 |
rhombischer Schwefel (kristallin,gelb): Besteht aus 16 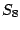 -Molekülen in der Elementarzelle -Molekülen in der Elementarzelle |
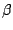 -S -S |
bis
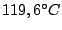 |
monokliner Schwefel (kristallin,gelb): Besteht aus einzelnen 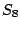 -Molekülen -Molekülen |
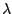 -S -S |
|
leichtflüssiger Schwefel (gelb): Besteht aus 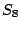 -Molekülen -Molekülen |
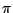 -S -S |
|
immer noch flüssig: Schwefel nimmt energiereichere Ringstrukturen mit 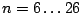 Atomen an Atomen an |
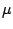 -S -S |
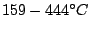 max bei max bei 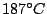 |
plastischer Schwefel in abgeschreckter Form. Plötzlich rotbraun und sehr zäh, so wie Kaugummi. Besteht aus 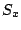 -Ketten -Ketten |
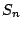 |
ab
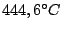 |
In der Gasphase befinden sich hauptsächlich einzelne S-Atome |
Alle Modifikationen sind reversibel. So zerfällt plastischer Schwefel mit der Zeit wieder zu monoklinen Schwefel, welcher dann auch wieder rhombisch wird.
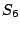 -Ringe entstehen bei der Zersetzung von Thiosulfaten mit Säuren: -Ringe entstehen bei der Zersetzung von Thiosulfaten mit Säuren:
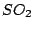 : :
Schwefeldioxid wird durch Verbrennen von Schwefel erzeugt:
Es ist ein Molekül mit zwei Doppelbindungen am Schwefel und hat v-förmige Struktur. Es verfügt über ein 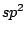 -Hybridorbital, sowie zwei -Hybridorbital, sowie zwei  -Bindungen. -Bindungen.
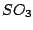 : :
Schwefeltrioxid wird mit Hilfe des Kontaktverfahres aus Schwefeldioxid und Sauerstoff hergestellt:
Bei Raumtemperatur liegt das Gleichgewicht auf der rechten Seite, jedoch läuft die Reaktion praktisch nicht ab. Bei hohen Temperaturen liegt das Gleichgewicht auf der linken Seite, da die Reaktion exotherm ist. Man benutzt deshalb 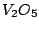 als Katalysator bei Temperaturen von als Katalysator bei Temperaturen von
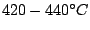 : :
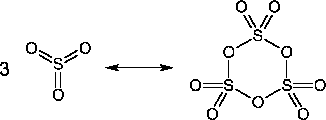
Es gibt verschiede Modifikationen des 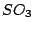 -Moleküls. In der Gasphase liegt folgendes Gleichgewicht vor. Man nennt diese Modifikation -Moleküls. In der Gasphase liegt folgendes Gleichgewicht vor. Man nennt diese Modifikation 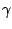 - -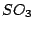 : :
Unterhalb der Raumtemperatur formt sich 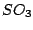 in asbestartige Nadeln, die in asbestartige Nadeln, die 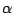 bzw. bzw. 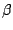 -Modifikation um. Diese Nadeln bestehen aus vielen hintereinandergereihten -Modifikation um. Diese Nadeln bestehen aus vielen hintereinandergereihten 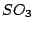 Molekülen, bei denen eine Doppelbindung aufgespalten wird und jeweil ein O-Atom für eine Verbindung zum nächsten ,,Molekül'' sorgt. Molekülen, bei denen eine Doppelbindung aufgespalten wird und jeweil ein O-Atom für eine Verbindung zum nächsten ,,Molekül'' sorgt.
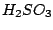 : :
Schweflige Säure wird durch Einleiten von 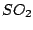 in Wasser hergestellt. in Wasser hergestellt. 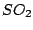 ist in Wasser gut löslich: ist in Wasser gut löslich:
Schweflige Säure ist ein schwache Säure.
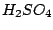 : :
Schwefelsäure hat folgende Strukturformel:
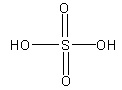
Schwefelsäure kann durch Einleiten von 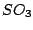 in Wasser hergestellt werden. Jedoch ist es in Wasser nicht so gut löslich. Deshalb wird in Wasser hergestellt werden. Jedoch ist es in Wasser nicht so gut löslich. Deshalb wird 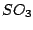 eingeleitet, wo es zu Dischwefelsäure reagiert, welche wiederum mit Wasser zu Schwefelsäure reagiert: eingeleitet, wo es zu Dischwefelsäure reagiert, welche wiederum mit Wasser zu Schwefelsäure reagiert:
Reine Schwefelsäure ist eine farblose, ölige Flüssigkeit, die Oleum genannt wird. Sie raucht, da sie verdunstet und an der Luft Wasser entzieht, welches zu Wassertröpfchen wird. Reine Schwefelsäure ist stark Wasserentziehend, weshalb es als Trocknungsmittel verwendet wird. Auf viele organische Stoffe wirkt Schwefelsäure verkohlend. Schwefelsäure ist ein starkes Oxidationsmittel.
|