Sauerstoffverbindungen Unterabschnitte
SauerstoffverbindungenChlor(I)-OxidAnhydrid der hypochlorigen Säure: Die Molekülstruktur ist gewinkelt, wie das Wasser. Die Bindungswinkel der einzelnen Moleküle:
ChlordioxidDie Molekülstruktur ist wieder gewinkelt: Dieses Gas entsteht bei der Zersetzung von chloriger Säure oder Chlorsäure Es ist explosiv. Dichlorheptaoxid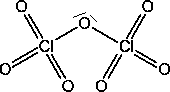
Es ist das Anydrid der Perchlorsäure: |