Unterabschnitte
Die freie Enthalpie G ist das Maß für die Triebkraft eines Prozesses. Ist
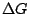 negativ, so findet eine Reaktion oder ein Zustandswechsel statt. negativ, so findet eine Reaktion oder ein Zustandswechsel statt.
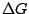 positiv, so findet keine Reaktion statt. positiv, so findet keine Reaktion statt.
Die Temperatur beeinflußt die freie Enthalpie. Ist sie hoch so verleiht sie der Enthalpie mehr Gewicht.
| Parameter |
Effekt |
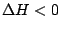 , ,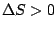 |
Die Reaktion läuft ab. Je höher 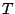 ist, desto intensiver ist die Reaktion. ist, desto intensiver ist die Reaktion. |
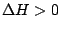 , ,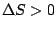 |
Läuft nur ab, wenn die Temperatur hoch ist. Beispiel ist das dissoziieren eines molekularen Gases bei hohen Temperaturen. |
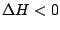 , ,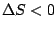 |
Temperatur muß möglichst gering sein, damit die Reaktion abläuft. Hierbei kann es wie bei der Synthese von 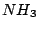 jedoch zu Problemen kommen, da die Reaktion nicht genügend Startenergie hat. jedoch zu Problemen kommen, da die Reaktion nicht genügend Startenergie hat. |
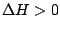 , ,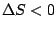 |
Hier läuft gar nichts ab. Eine Reaktion bei der die Enthropie gestiegen ist und die auch noch exotherm war, kann nicht spontan rückwärts ablaufen. |
|