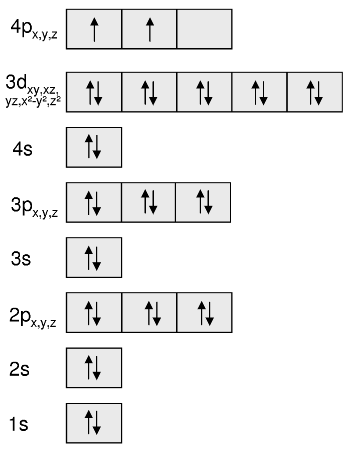
Der Übersichtlichkeit halber gibt es eine skizzenhafte Darstellung der ,,Schalen'' (also Orbitale) von Atomen sowie Ionen, in denen die einzelnen Orbitale als Kästen eingezeichnet werden, die entweder von einem oder von zwei Elektronen, die als entgegengesetzte Pfeile dargestellt werden, besetzt sind.
Als Beispiel sei das Germaniumatom (Ge) dargestellt:
Die Formelschreibweise dieser Elektronenkonfiguration lautet
Dabei steht 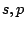 und und 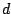 für die Art der Orbitale, die Zahl davor für das Energieniveau der Orbitale, wobei für die Art der Orbitale, die Zahl davor für das Energieniveau der Orbitale, wobei 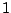 die kleinste Energie ist und die Potenzzahlen für die Anzahl der Elektronen, die dieses Orbital besetzen. Man kann die Elektronenkonfiguration abkürzend aufschreiben, indem man für die vollbesetzten Orbitale der Periode davor das Element der Edelgase dieser Periode in eckigen Klammern schreibt. In der oben angegebenen Konfiguration ist es das Element Argon. die kleinste Energie ist und die Potenzzahlen für die Anzahl der Elektronen, die dieses Orbital besetzen. Man kann die Elektronenkonfiguration abkürzend aufschreiben, indem man für die vollbesetzten Orbitale der Periode davor das Element der Edelgase dieser Periode in eckigen Klammern schreibt. In der oben angegebenen Konfiguration ist es das Element Argon. ![$[Ar]$](img101.png) meint, daß die Konfiguration des Argons plus der danach aufgeschriebenen Konfiguration besteht.
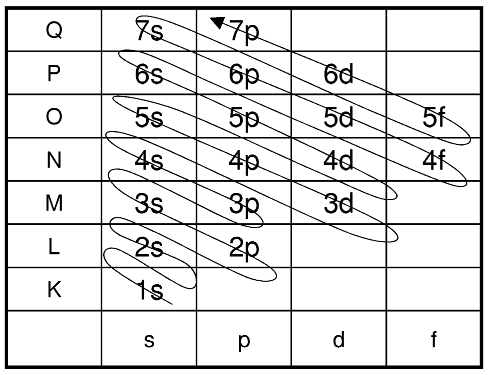
Die Energien der einzelnen Orbitale einer Schale sind nicht gleich. Demzufolge wird nicht eine Schale ganz besetzt, bevor die nächste Schale angebrochen wird. Die Besetzung der Schalen kann man aus Schaubild unten entnehmen. meint, daß die Konfiguration des Argons plus der danach aufgeschriebenen Konfiguration besteht.
Die Energien der einzelnen Orbitale einer Schale sind nicht gleich. Demzufolge wird nicht eine Schale ganz besetzt, bevor die nächste Schale angebrochen wird. Die Besetzung der Schalen kann man aus Schaubild unten entnehmen.
|