Unterabschnitte
Es gibt verschiedene Theorien, nach welchen sich die Struktur der Moleküle bestimmen lassen. Auch mit den obigen Molekülorbitalen läßt sich schon einiges voraussagen.
Die Hybridisierung ist ein Modell, mit welchem sich die Geometrie von Molekülen erklären kann. Dabei mischt man die einzelnen vorhandenen Atomorbitale zu einem Orbital zusammen, welches dann andere geometrische Struktur hat.
Zur Bezeichnung des Mischorbitals nennt man alle Ausgangsorbitale mit ihren Kleinbuchstaben und schreibt an jedes Ausgangsorbital, wie oft Orbitale von diesem Typ in die Mischung mit einfließen. Als Beispiel ergibt die Mischung von einem s-Orbital und 3 p-Orbitalen das 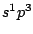 -Orbital, wobei man die -Orbital, wobei man die 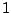 auch weglassen kann. auch weglassen kann.
Tabelle der häufigsten hybridisierten Orbitale, ihre geometrische Struktur, sowie einige Stoffe in denen sie vorkommen:
| Oribtal |
Geometrie |
Vorkommen |
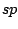 |
linear |
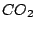 , ,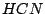 , ,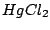 , ,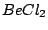 |
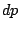 |
linear |
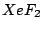 , ,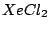 |
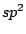 |
trigonal planar |
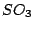 , ,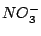 , ,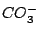 , ,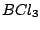 |
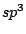 |
tetraedrisch |
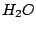 , ,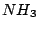 , ,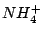 , ,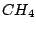 , ,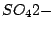 , ,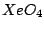 |
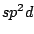 |
quadratisch |
|
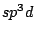 |
trigonal bipyramidial |
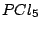 , ,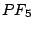 , ,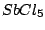 |
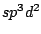 |
oktaedisch |
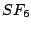 |
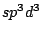 |
pentagonal-bipyramidial |
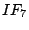 |
Hinweis: Das d-Oribtal des 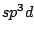 -Orbitals ist das -Orbitals ist das 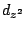 -Oribtal, also die Hantel mit dem Ring. Bei weiter steigender Anzahl von eingemischten d-Oribtalen werden ,,normale'' d-Orbitale mit hinzugemischt. -Oribtal, also die Hantel mit dem Ring. Bei weiter steigender Anzahl von eingemischten d-Oribtalen werden ,,normale'' d-Orbitale mit hinzugemischt.
Bei organischen Molekülen treten auch Hybridisierungen auf. So ist das Methanmolekül 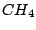 wie oben schon beschrieben wie oben schon beschrieben 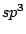 -hybridisiert und ein Tetraeder. Ist ein Kohlenstoffatom mit vier anderen Bindungspartnern versehen, so ist es -hybridisiert und ein Tetraeder. Ist ein Kohlenstoffatom mit vier anderen Bindungspartnern versehen, so ist es 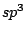 -hybridisiert. Mit der -hybridisiert. Mit der 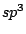 -Hybridisierung läßt sich auch die gewinkelte Struktur einer Kohlenstoffkette beschreiben. Die Atome hängen nicht gerade, wie auf einer Perlenschnur aufgereiht, sondern sie sind zickzackförmig angereiht. Dies kommt zu stande, in dem ein weiteres C-Atom immer an einer Ecke des Tetraeders hängt und nicht an der Seite. Kommen in organischen Verbindungen Doppelbindungen an C-Atomen vor, so ist das C-Atom -Hybridisierung läßt sich auch die gewinkelte Struktur einer Kohlenstoffkette beschreiben. Die Atome hängen nicht gerade, wie auf einer Perlenschnur aufgereiht, sondern sie sind zickzackförmig angereiht. Dies kommt zu stande, in dem ein weiteres C-Atom immer an einer Ecke des Tetraeders hängt und nicht an der Seite. Kommen in organischen Verbindungen Doppelbindungen an C-Atomen vor, so ist das C-Atom 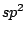 -hybridisiert. An dieser Doppelbindung ist ein s-Orbital und ein p-Orbital beteiligt, während die beiden anderen Orbitale weiterhin zur Bindung von Substituenten zur Verfügung stehen. Doppelbindungen verursachen keine gewinkelte Struktur mehr. Weiterhin lassen sie das Atom starr werden, so daß es sich um die Doppelbindung nicht mehr drehen kann und planar ist. Eine Dreifachbindung wird durch ein s-Oribtal und zwei p-Oribtale eines -hybridisiert. An dieser Doppelbindung ist ein s-Orbital und ein p-Orbital beteiligt, während die beiden anderen Orbitale weiterhin zur Bindung von Substituenten zur Verfügung stehen. Doppelbindungen verursachen keine gewinkelte Struktur mehr. Weiterhin lassen sie das Atom starr werden, so daß es sich um die Doppelbindung nicht mehr drehen kann und planar ist. Eine Dreifachbindung wird durch ein s-Oribtal und zwei p-Oribtale eines 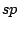 -hybridisierten Orbitals gebildet. Hierbei ist das Molekül eine Gerade.
Herkunft der Abkürzung: -hybridisierten Orbitals gebildet. Hierbei ist das Molekül eine Gerade.
Herkunft der Abkürzung:
VSEPR = Valence shell electron pair repulsion
Regeln:
- Die Elektronen/Liganden ordnen sich mit maximalem Abstand auf der Kugeloberfläche um das Zentralatom zueinander an.
- Einsame Elektronenpaare beanspruchen mehr Raum als bindende Elektronenpaare (also Atome)
- Doppelbindungen beanspruchen mehr Raum als Einfachbindungen.
- Der Raumbedarf eines Liganden wird mit steigender Elektronegativität kleiner.
Tabelle der Strukturen:
| Elektronenpaare |
Geometrie der Elektronenpaare |
Molekültyp |
Molekülgestalt |
Beispiele |
| 2 |
linear |
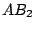 |
linear |
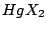 , ,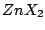 , ,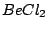 |
| 3 |
dreieckig-planar |
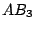 |
dreieckig-planar |
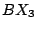 , ,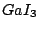 |
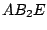 |
V-förmig |
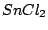 |
| 4 |
tetraedrisch |
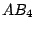 |
tetraedrisch |
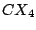 , ,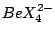 , ,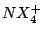 |
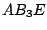 |
trigonal-pyramidial |
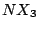 , ,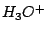 , ,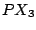 |
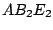 |
V-förmig |
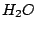 , ,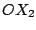 , ,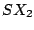 |
| 5 |
trigonal-bipyramidial (tetraedrisch-bipyramidial) |
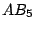 |
trigonal-bipyramidial |
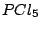 , ,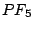 , ,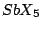 |
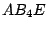 |
tetraedrisch-verzerrt |
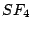 , ,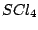 , ,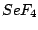 |
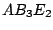 |
T-förmig |
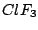 , ,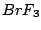 |
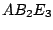 |
linear |
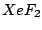 , ,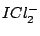 , ,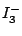 |
| 6 |
oktaedrisch (quadratisch-bipyramidial) |
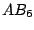 |
oktaedrisch |
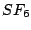 , ,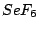 , ,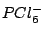 , ,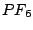 |
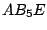 |
quadratisch-pyramidial |
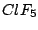 , ,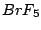 , ,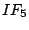 |
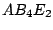 |
quadratisch-planar |
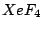 |
| 7 |
pentagonal-bipyramidial |
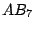 |
pentagonal-bipyramidial |
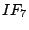 , ,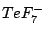 |
Mit der Molekülorbitaltheorie läßt sich nicht die Geometrie einer Verbindung voraussagen. Dafür kann man jedoch die Bindungsordnung aus der Besetzung der Molekülorbitale berechnen, sowie ersehen, ob ein Molekül paramagnetisch oder diamagnetisch.
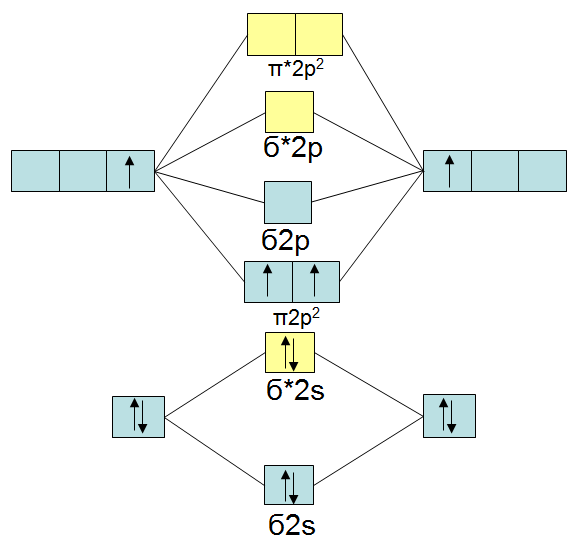
Das Standardmolekülorbitalschema für ein Molekül mit zwei gleichen Atomen am Beispiel von Dibor (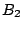 ): ):
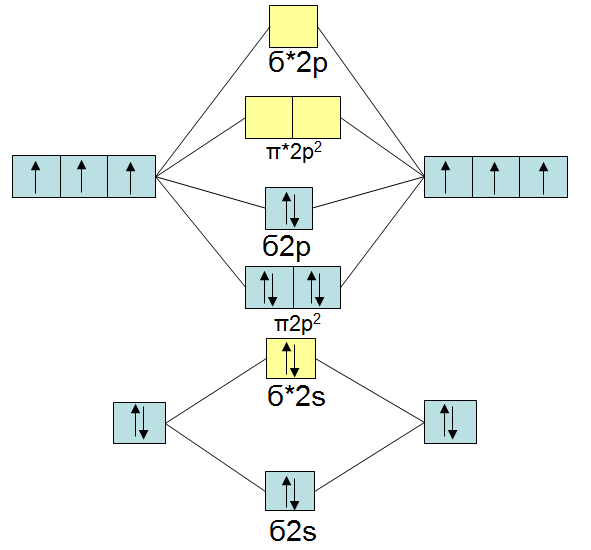
Bei Distickstoff (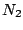 ) rutscht das antibindende ) rutscht das antibindende 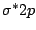 über das antibindene über das antibindene 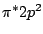 -Oribtal: -Oribtal:
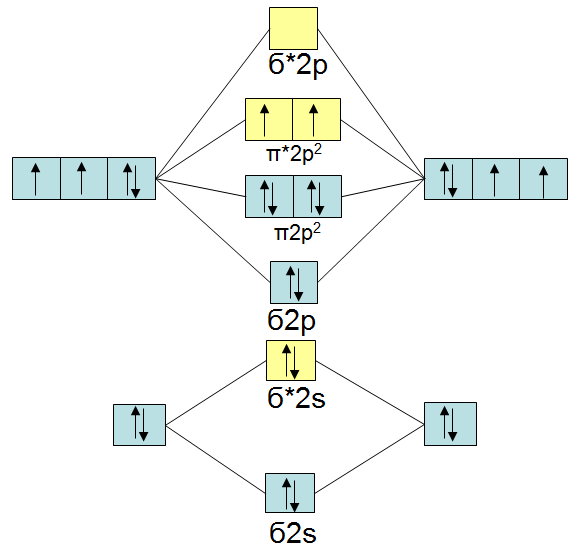
Bei Sauerstoff und Fluor rutscht dann das 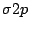 -Orbital unter die beiden bindenden -Orbital unter die beiden bindenden 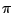 -Orbitale. Im Folgenden das MO-Schema von Sauerstoff:
Sauerstoff hat die paramagnetische Eigenschaft. Dies ist daraus zu erkennen, daß das Molekül in den beiden antibindenden -Orbitale. Im Folgenden das MO-Schema von Sauerstoff:
Sauerstoff hat die paramagnetische Eigenschaft. Dies ist daraus zu erkennen, daß das Molekül in den beiden antibindenden 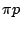 -Oribtalen nur ein Elektron hat. Paramagnetisch heißt hier, daß das Molekül auf Magnetismus reagiert und selbst auch magnetisch ist. -Oribtalen nur ein Elektron hat. Paramagnetisch heißt hier, daß das Molekül auf Magnetismus reagiert und selbst auch magnetisch ist.
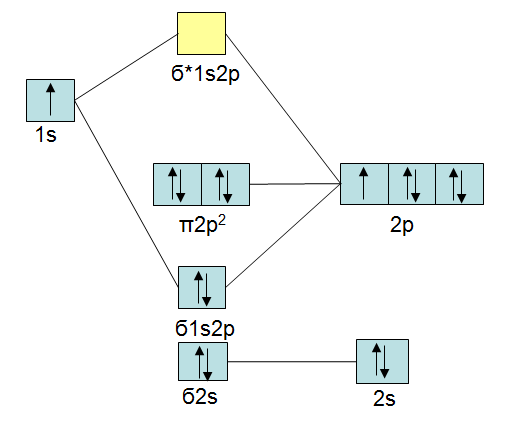
Wenn ein Atom der Bindung eine höhere Elektronegativität hat als das andere, dann wirkt sich dies auf die Energie der Atomorbitale aus, indem die Atomorbitale des elektronegativeren Atoms geringe Energie haben. Als Beispiel sei das MO-Schema von HF gegeben:
Das Beispiel von Fluorwasserstoff ist das einfachste Beispiel. Verbindungen zwischen Elementen der zweiten Periode selbst sind auch noch verhältnismäßig einfach. Schwierig wird es bei Elementen aus unterschiedlichen Perioden.
Wenn zwei Verbindungen das selbe MO-Schema haben, dann nennt man diese beiden Verbindungen isoelektronisch zueinander.
Berechnung der Bindungsordnung:
Hierbei sind
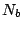 : Anzahl der Elektronen in bindenden MO. : Anzahl der Elektronen in bindenden MO.
und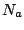 : Anzahl der Elektronen in nichtbindenden MO. : Anzahl der Elektronen in nichtbindenden MO.
|