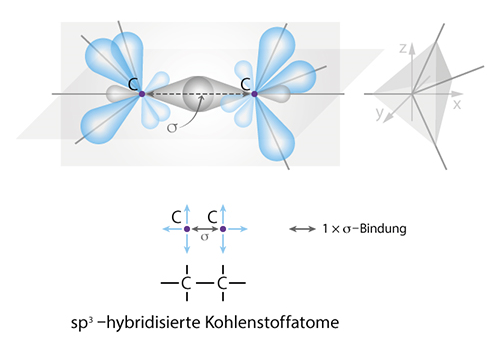
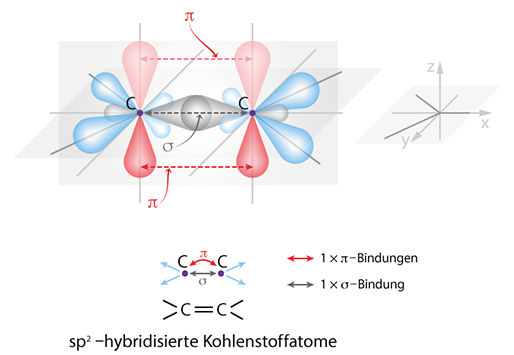
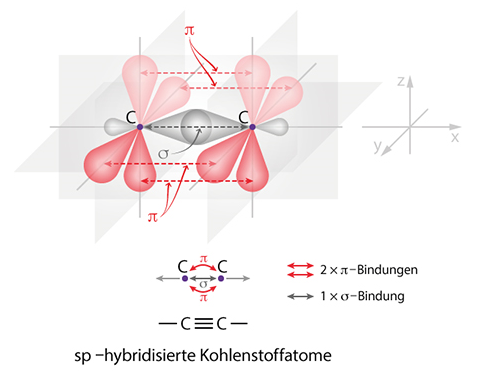
Je nachdem wieviele Nachbarschaftsatome der Kohlenstoff hat, wird er unterschiedlich hybridisiert und geht unterschiedliche Bindungen ein. Insgesamt kennt er drei Bindungstypen.
Die Einfachbindung ist als einzige in sich selbst drehbar. An jeder Seite der Einfachbindung gibt es drei weitere an den Kohlenstoff gebundene Atome. Die Energie der Bindung ist
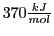 und ist damit schwächer als die Bindung zwischen Kohlenstoff und Wasserstoff bei
und ist damit schwächer als die Bindung zwischen Kohlenstoff und Wasserstoff bei
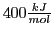 .
.
In der Doppelbindung überlappen sich jeweils ein p-Oribtal des einen
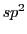
-hybridisierten C-Atoms mit dem anderen. Diese Bindung wird
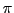
-Bindung genannt. Die Bindung nicht mehr drehbar, da sonst diese
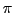
-Bindung gespalten werden müsste. Die Energie der Bindung ist
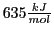
. Allerdings ist hierbei darauf zu achten, dass zwei weitere Wasserstoffatome keine Bindung eingehen können, was viel Energie bringen würde, wenn die Doppelbindung nicht gebildet wird.
In der Dreifachbindung überlappen sich schließlich zwei
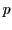
-Oribtale auf jeder Seite. Somit werden zwei
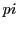
-Bindungen gebildet. Die Dreifachbindung ist verständlicherweise auch nicht drehbar. Die Bindungsenergie ist
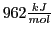
. Allerdings verlieren wieder zwei weitere Wasserstoffatome ihren Bindungspartner, wenn sie denn nun vorhanden wären.
![]() und ist damit schwächer als die Bindung zwischen Kohlenstoff und Wasserstoff bei
und ist damit schwächer als die Bindung zwischen Kohlenstoff und Wasserstoff bei
![]() .
.