Unterabschnitte
AtombindungenLewisformelnAtome haben eine äußere Elektronenschale, die Valenzelektronenschale genannt wird. In dieser befinden sich die Elektronen, die bei chemischen Reaktionen von Bedeutung sind. Diese Elektronen werden nun in Lewisformeln eingezeichnet und zwar verwendet man einen PunktOktettregelAtome versuchen ihre Elektronen so zu teilen, daß sie möglichst 8 Elektronen in der Außenschale haben. Dies ist zwingend notwendig für die Elemente Fluor, Sauerstoff, Stickstoff und Kohlenstoff in der ersten Achterperiode. Diese Elemente haben als Bindungsordnung die Anzahl der Elektronen, die ihnen fehlen.Ausnahmen von der OktettregelElemente, die schon Edelgaskonfiguration haben, können (meistens) keine Bindungen zu anderen Elementen eingehen.Lithium kann 1 Elektron aufnehmen. Beryllium 2, da ein p-Oribtal mit besetzt wird. Bor kann 3 Elektronen aufnehmen, da zwei p-Orbitale mit besetzt werden. Die Bindigkeit ist jeweils 1,2 und 3. Atome die aus höheren Perioden stammen (wie z.B. Schwefel oder Phosphor können auch d-Orbitale einfach mit Elektronen auffüllen, weshalb diese auch mehr als 8 Elektronen in der Valenzelektronenschale haben können. Bestimmung der Bindungsordnung mit Hilfe der LewisformelnUm die Oktettregel zu erfüllen, müssen manche Atome mehrere Bindungen zu anderen Atomen eingehen. So hat zum BeispielFormale LadungenFormale Ladungen sind rein fiktive Ladungen und haben praktisch keine Bedeutung. Ladungen befinden sich in einem Molekül (außer bei Ionen) nicht auf einer Seite des Moleküls, sondern Elektronen werden nur in eine Richtung etwas ,,gezogen'' (siehe Partielle Ladungen).Die Formale Ladung wird bestimmt, in dem alle Bindungen einfach in der Mitte geschnitten werden, so daß von jedem bindenen Elektronenpaar jeweils ein Elektron dem einen und das andere dem anderen Atom zufällt. Dann werden die Elektronen gezählt. Hat das Atom mehr Elektronen als im Urzustand, so ist es negativ. Hat es weniger positiv. Man schreibt Es kann passieren, daß formale Ladungen in einem Molekül nicht wieder ausgeglichen werden. Dieses Molekül ist dann ein Ion wie zum Beispiel das Carbonat-Ion oder das Partielle LadungenPartielle Ladungen sind tatsächliche Ladungen. Zieht ein Atom des Moleküls wegen seiner höheren Elektronegativität die Bindungselektronen mehr an als andere Atome, so ist es negativ geladen und die anderen Atome positiv. Man schreibt:So ist zum Beispiel beim Wasser, das Sauerstoffatom partiell negativer geladen, als die Wasserstoffatome. Mesomere GrenzformelnEs gibt Moleküle und Ionen, bei welchen Doppelbindungen und freie Elektronenpaare auf verschiedene Art und Weise angebracht werden können. Diese Moleküle haben eine Mesomerie. Nicht eine Möglichkeit der Anordnung der Elektronenpaare wird gewählt, sondern alle gleichzeitig, wobei alle Möglichkeiten inneinander verwischt sind und die mit den Lewisformeln oben gezeichnete Formeln nur Grenzformeln sind, welche fast nie eintreten.Verschiedene Mesomere Grenzformeln haben
VB-Theorie (Valence Bond-Theorie)Die experimentell bestimmte Bindungsenergie von
A,B: Atomorbitale
1,2: Elektronen
LCAO-Methode (Linearkombination von Atomorbitalen)Um eine Nährung des Moleküloribtals zu erstellen, werden bei der LCAO Methode zwei Atomorbitale als bindendes Molekülorbital addiert oder als antibindendes Molekülorbital subtrahiert. Betrachten wir die Molekülorbitale der beiden Moleküle A und B: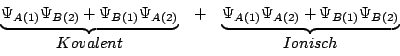
Verschiedene MolekülorbitaleMolekülorbitale bilden sich also folglich durch Überlappung von Atomorbitalen. Es gibt s,p,d usw. Atomorbitale. Nur positive Orbitalteile, die sich überlappen, können eine Bindung bilden. Überlappt ein positiver Teil gleichermaßen einen positiven Teil und einen negativen Teil eines anderen Atomorbitals, so gibt es keine Bindung. Es gibt zwei verschiedene Arten von Bindungen:
|