Unterabschnitte
IonenbindungenLadung und Namen von IonenPositiv geladene Ionen werden als Kationen bezeichnet. Negative als Anionen. Um die Ladung der Ionen zu kennzeichnen schreibt man meistens einKräfte zwischen IonenIonen ziehen sich gegenseitig an. Hierbei ist die Anziehungskraft nicht in eine Richtung wirksam, sondern sie verteilt sich auf den gesamten Raum. Sie wird beschrieben durch das Coulumbsche Gesetz (vgl. Borsches Atommodell) Es lagern sich möglichst viele andersgeladene Ionen um ein Ion. Die Anzahl der Ionen die sich um ein Ion herumlagern ist von der Größendifferenz beider Ionen abhängig und bestimmt die Kristallstruktur. Ionen stoßen sich jedoch auch gegenseitig ab, da sich die Elektronenhüllen beider Ionen abstoßen. Deshalb berühren sich die Ionen im Kristallgitter nicht, bilden aber trotzdem eine feste, schwer zu lösende Bindung, weshalb Kristalle spröde sind und einen hohen Schmelzpunkt haben.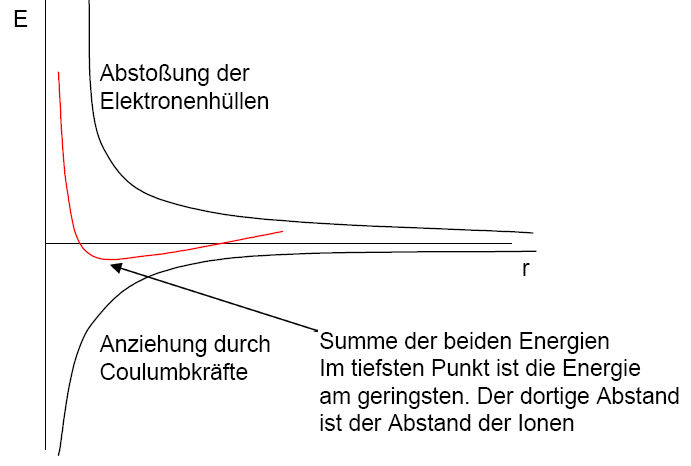 Verschiedene KristallstrukturenEs gibt verschiedene Ionenkristallstrukturen. Da sich immer die gleiche Anzahl an andersgeladenen Ionen um ein Ion lagern kann, ergibt sich daraus eine Struktur, die sich in der eckigen Struktur von Kristallen niederschlägt.Andere KristalleNeben Ionenkristallen gibt es jedoch auch noch andere Kristalle. Dies können
GitterenergieNähern sich Ionen im Raum und nehmen sie ein Kristallgitter ein, so wird Gitterenergie frei. Haben Stoffe eine hohe Gitterenergie, so ist ihr Kristallgitter sehr fest.Born-Haber-ZyklusBei der Reaktion von z.B. Natrium mit Clorid sind verschiedene Energien von Nöten, damit die Reaktion überhaupt abläuft. Im Born-Haber-Zyklus sind die Energien aufgelistet, die benötigt werden, um die einzelnen Atome in einem reaktionsfähigen Zustand zu bringen. Weiterhin sind hier auch die Energien enthalten, die bei der letztendlichen Reaktion wieder frei werden.
Alle freiwerdenden Energien sind negativ. Alle benötigten Energien positiv. Solvatationsenergie (Hydratationsenergie) und DissoziationsenergieDie Solvatationsenergie ist diejenige Energie die freigesetzt wird (negativer Wert) wenn ein Stoff in Lösung geht. Stoffe können sich in unterschiedlichen Stoffen lösen. Speziell für Wasser heißt die Solvatationsenergie auch Hydratationsenergie.Die Dissoziationsenergie ist die Energie, welche benötigt wird (positiver Wert) um das Kristallgitter zu trennen. LösungsenthalpieBei manchen Ionenkristallen wird Energie frei, wenn man sie auflöst, (d.h. die Lösungsenthalpie ist negativ). Hierbei überwiegt die Solvatationsenergie. Bei manchen Kristallen wird Energie dem umgebenden System entzogen, (d.h. die Lösungsenthalpie ist positiv) wenn man sie auflöst. Hierbei überwiegt die Dissoziationsenergie. Das dieser Vorgang überhaupt abläuft ist der Enthropie zu verdanken. Da gelöste Ionen ,,unordentlicher'' angeordnet sind, wird dieser Zustand eingenommen.Beim Auflösen kann die Lösung also entweder wärmer oder kälter werden. Salze sind ElektrolyteElektrolyte sind Leiter von Elektronen. Salze in ungelöster Form leiten den elektrischen Strom nicht, da die Ionen fest im Kristallgitter sind. Salze in gelöster Form oder in geschmolzener Form jedoch leiten den Strom, da die Ionen beweglich sind. |