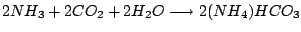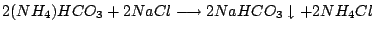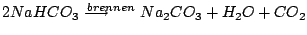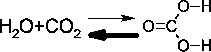Kohlenstoff Unterabschnitte
 Kohlenstoff kommt in der Natur fast überall vor. Die größten vorkommen sind in Carbonaten z.B.
Kohlenstoff kommt in der Natur fast überall vor. Die größten vorkommen sind in Carbonaten z.B.
Vom Kohlenstoff gibt es zwei polymorphe Modifikationen Graphit und Diamant. Dabei ist die Graphitmodifikation die unter Normalbedingungen stabilste Modifikation. Diamant entsteht, wenn man Graphit unter Druck setzt.
Im Graphit sind die Kohlenstoffatome 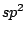 -hybridisiert. Deshalb ist Graphit aus Schichten aufgebaut. Jedes Kohlenstoffatom hat drei Kohlenstoffbindungspartner. Ein einzelnes p-Elektron bleibt an jedem C-Atom frei. 6 C Atome bilden im Graphit einen Ring. Mit dem freien Elektron bildet jedes C-Atom zu einem seiner Nachbarn eine weitere -hybridisiert. Deshalb ist Graphit aus Schichten aufgebaut. Jedes Kohlenstoffatom hat drei Kohlenstoffbindungspartner. Ein einzelnes p-Elektron bleibt an jedem C-Atom frei. 6 C Atome bilden im Graphit einen Ring. Mit dem freien Elektron bildet jedes C-Atom zu einem seiner Nachbarn eine weitere 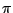 -Bindung, so daß eine Doppelbindung vorhanden ist. Die Elektronen sind praktisch über das ganze Makromolekül delokalisiert, da zwischen drei mesomeren Grenzformeln gewechselt wird. : -Bindung, so daß eine Doppelbindung vorhanden ist. Die Elektronen sind praktisch über das ganze Makromolekül delokalisiert, da zwischen drei mesomeren Grenzformeln gewechselt wird. :
Im Diamant sind die C-Atome 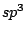 -hybridisiert und tetraedisch von 4 anderen C-Atomen umgeben. Da keine freien Elektronen vorhanden sind, leitet Diamant den Strom nicht.
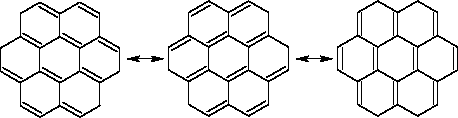
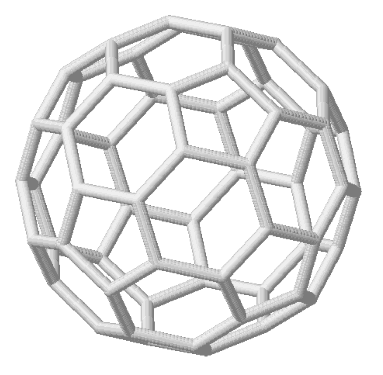
Kohlenstoff kommt auch in allotropher Modifikation vor, den Fullerenen. Das stabilste unter ihnen ist das -hybridisiert und tetraedisch von 4 anderen C-Atomen umgeben. Da keine freien Elektronen vorhanden sind, leitet Diamant den Strom nicht.
Kohlenstoff kommt auch in allotropher Modifikation vor, den Fullerenen. Das stabilste unter ihnen ist das 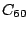 -Molekül, es besteht aus 20 6-Ecken und 12 5-Ecken, genau wie ein Fußball. Es gibt noch viele andere Fullerene, die andere Anzahlen an Kohlenstoffatomen haben2. Hier das -Molekül, es besteht aus 20 6-Ecken und 12 5-Ecken, genau wie ein Fußball. Es gibt noch viele andere Fullerene, die andere Anzahlen an Kohlenstoffatomen haben2. Hier das 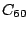 -Molekül: -Molekül:
Durch kosmische Strahlung wird in der höheren Athmosphäre der Kohlenstoff des 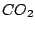 zu dem radioaktiven Kohlenstoff zu dem radioaktiven Kohlenstoff 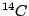 aktiviert. Die Halbwertszeit dieses Kohlenstoffs beträgt 5730 Jahre. Nun wird dieser Kohlenstoff in die Pflanzen und Tiere eingebaut. Lebende Pflanzen und Tiere nehmen immer wieder neu diesen Kohlenstoff auf, so daß die Konzentration dieses Kohlenstoffs in ihnen gleich bleibt. Sterben sie jedoch ab, so sinkt die Konzentration an aktiviert. Die Halbwertszeit dieses Kohlenstoffs beträgt 5730 Jahre. Nun wird dieser Kohlenstoff in die Pflanzen und Tiere eingebaut. Lebende Pflanzen und Tiere nehmen immer wieder neu diesen Kohlenstoff auf, so daß die Konzentration dieses Kohlenstoffs in ihnen gleich bleibt. Sterben sie jedoch ab, so sinkt die Konzentration an 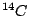 in ihnen. Mit Hilfe der Restkonzentration läßt sich das Alter der abgestorbenen organischen Materialien in Fossilien bestimmen. in ihnen. Mit Hilfe der Restkonzentration läßt sich das Alter der abgestorbenen organischen Materialien in Fossilien bestimmen.
Diese Methode setzt voraus, dass immer die gleiche kosmische Strahlung auf die Erde gestrahlt worden ist,
sowie auch der CO2-Gehalt der Luft konstant gewesen ist, so dass
man die für dieses Verfahren notwendige konstante Konzentration von 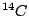 zur Verfügung hat. Da Strahlung wie CO2-Gehalt
nicht mehr rückwirkend gemessen werden können, wird die Annahme der
Konstantheit gemacht.
Andere Verfahren zeigen für gleiche Proben jedoch erheblich abweichende
Jahreswerte, woraus sich schließen lässt, dass diese Annahmen falsch sind. Da
jedoch keine bessere Methode vorhanden, wird die zur Verfügung hat. Da Strahlung wie CO2-Gehalt
nicht mehr rückwirkend gemessen werden können, wird die Annahme der
Konstantheit gemacht.
Andere Verfahren zeigen für gleiche Proben jedoch erheblich abweichende
Jahreswerte, woraus sich schließen lässt, dass diese Annahmen falsch sind. Da
jedoch keine bessere Methode vorhanden, wird die 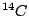 -Methode weiterhin verwendet.
Darstellung: -Methode weiterhin verwendet.
Darstellung:
Man kann Kohlenmonoxid herstellen, indem man das Wasser aus der Ameisensäure mit Hilfe von 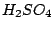 entzieht. Schwefelsäure ist stark wasserentziehend: entzieht. Schwefelsäure ist stark wasserentziehend:
Des weiteren ist im Generatorgas, welches aus Luft und Kohlenstoff unter Temperatur gebildet wird, 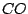 enthalten: enthalten:
Auch im Wassergas ist 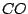 enthalten: enthalten:
CO ist stark toxisch. Es bindet sich an die roten Blutkörperchen und verhindert den Sauerstofftransport im Körper.
Darstellung im Labor: (alternativ kann man auch 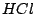 verwenden) verwenden)
Nachweis mit Kalkwasser (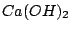 ) )
Kohlensäure entsteht beim Einleiten von 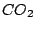 in Wasser. Sie ist jedoch sehr unbeständig und zerfällt sehr schnell wieder (glücklicherweise): in Wasser. Sie ist jedoch sehr unbeständig und zerfällt sehr schnell wieder (glücklicherweise):
Da Kohlensäure zweiwertig ist, gibt es zwei Salzreihen, da die Salze anders als die Kohlensäure selbst, doch beständig sind:
| Anzahl der Metallatome |
Salz |
| 1 |
Hydrogencarbonat z.B. 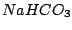
(saure Carbonate)
gut wasserlöslich außer 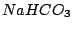 |
| 2 |
Carbonat z.B. 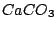
(neutrale Carbonate)
nur Alkalicarbonate sind wasserlöslich |
Das Carbonation 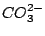 verfügt über eine delokalisierte verfügt über eine delokalisierte 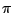 -Bindung. Es ist planar und die Bindungswinkel zwischen den C-Atomen betragen -Bindung. Es ist planar und die Bindungswinkel zwischen den C-Atomen betragen 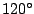 .
Wasser hat temporäre und permantente Härte. Die temporäre Härte wird durch Erhitzen entfernt. Sie bildet sich aus Carbonaten, welche unter Hitze zerfallen. Hauptsächlich ist dies .
Wasser hat temporäre und permantente Härte. Die temporäre Härte wird durch Erhitzen entfernt. Sie bildet sich aus Carbonaten, welche unter Hitze zerfallen. Hauptsächlich ist dies 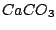 . Permanente Härte kann nicht durch Erhitzen entfernt werden.
Soda (Natriumcarbonat) wird zur Herrstellung von Wasserglas, Waschmitteln und Natriumsalzen gebraucht. Es wird in der Industrie in enormen Mengen benötigt. . Permanente Härte kann nicht durch Erhitzen entfernt werden.
Soda (Natriumcarbonat) wird zur Herrstellung von Wasserglas, Waschmitteln und Natriumsalzen gebraucht. Es wird in der Industrie in enormen Mengen benötigt.
Hergestellt wird es in dem Solvayverfahren aus Natriumchlorid und Calciumchlorid. Alle anderen Reaktionsteilnehmer sind im Kreislauf und verbrauchen sich nicht:
Hauptreaktionen:
-
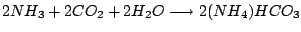
-
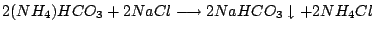
Hier wird ausgenutzt, daß Natriumhydrogencarbonat schlecht löslich ist. Es fällt aus.
-
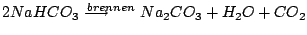
Zur Rückgewinnung von 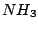 aus aus  : :
-
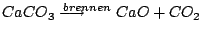
-
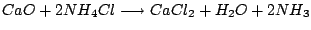
|