Unterabschnitte
Galvanisches ElementSchaubild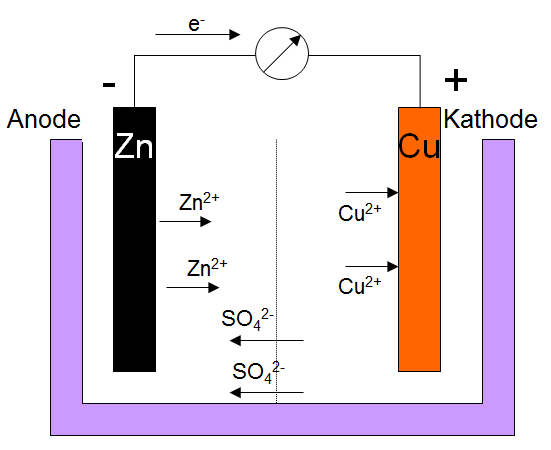
Batterie/AkkumulatorEine Batterie ist ein galvanisches Element. Im Handel sind viele verschiedene Batterien. Eine Batterie kann jedoch nicht wieder geladen werden, während in einem Akkumulator auch eine Elektrolyse zum wiederbeladen desselben stattfinden kann. Somit kann man das System Galvanisches Element/Elektrolyseelement als Stromspeicher verwenden.NormalwasserstoffhalbzelleDie Normalwasserstoffhalbzelle besteht aus einer platinierten Platinelektrode über die in Wasser Wasserstoff mit einem Druck vonNun kann der Strom fließen und zwar fließt er entweder von der Normalwasserstoffhalbzelle in die andere Zelle, dann ist die Normalwasserstoffhalbzelle die Anode und das Redoxpotential der anderen Zelle ist positiv oder der Strom fließt von der anderen Zelle in die Normalwasserstoffhalbzelle. Hierbei ist die Normalwasserstoffhalbzelle die Kathode und das Redoxpotential der anderen Zelle ist negativ. SpannungsreiheIn der Spannungsreihe sind die Standardpotentiale der Normalwasserstoffhalbzelle gegenüber anderen Halbzellen aufgetragen. Aus dieser Gleichung kann man ablesen, wie die einzelnen Zellen unter Normalbedingungen miteinander reagieren. Die Spannung zwischen den einzelnen Zellen wird die Differenz der Standardpotentiale unter Normalbedingungen sein. Hier ein Ausschnitt aus der Tabelle:
Berechnung von Redoxpotentialen mit Hilfe der Nernstschen GleichungDie Nernstsche Gleichung lautetNachdem man die Konstanten zusammenfaßt und auch die Temperatur auf die Normaltemperatur von Beim Einsetzen in die Nernstsche Gleichung muß man darauf achten, daß die Konzentrationen fester Reaktionspartner immer gleich 1 sind. Dies sind die Elektronen. Beispiel: Eine Kupferhalbzelle hat eine Konzentration von Kupfersulfit Somit ist das Potential dieser Halbzelle |