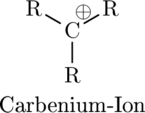Besonderheit des Kohlenstoffs
Eigentlich gibt es nur eine Chemie; anorganische und organische Chemie sowie auch sonstige Gebiete der Chemie fließen zusammen und bilden eine große Chemie. Jedoch hat Kohlenstoff einen derartigen Bindungsreichtum, dass mit Hilfe von Kohlenstoff eine Vielzahl an Verbindungen hergestellt werden kann und somit der Kohlenstoff eines eigenen Gebietes in der Chemie würdig ist.Der hohe Bindungsreichtum des Kohlenstoffatoms resultiert aus seiner mittleren Reaktiviät und seiner Eigenschaft Einfach-, Zweifach und Dreifach-Bindungen mit Hilfe von Hybridisierung ausbilden zu können. Des weiteren sind seine Verbindungen sehr stabil. Geht man in der gleichen Gruppe des Periodensystems herunter zum Silizium, so sind die Moleküle mit Silizium als Grundgerüst wesentlich instabiler als die Moleküle mit Kohlenstoff als Grundgerüst.
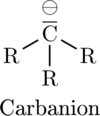
Allerdings bildet wegen des hohen Ionisierungspotentials Kohlenstoff (fast) keine mehrfach geladene Ionen. Jedoch sind Ionen des Kohlenstoffs mit einfacher Ladung reaktive Intermediate wie das positiv geladene Carbenium-Kation und das negativ geladene Carbanion (welches über ein freies Elektronenpaar, welches zusammen mit dem zusätzlichen Elektron gebildet wird, verfügt).