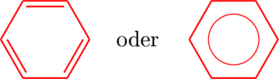Benzen (alter Begriff: Benzol) ist ein 6-er-Ring aus C-Atomen bei dem theoretisch jede zweite Bindung eine Doppelbindung, gebildet aus einer
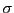
-Bindung und einer
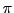
-Bindung, ist. Es handelt sich also theoretisch um 1,3,5-Cyclohexatrien. Die Energie liegt doch weit unter der berechneten Energie für Cyclohexatrien (nämlich mit genau
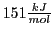
Differenz), so dass Benzen den Chemikern ein Rätsel aufgegeben hat.
Lange Zeit hat man des weiteren über die Struktur des Benzens gerätselt und verschiedene verrückte Strukturen gezeichnet. Dewar beispielsweise stellte drei Grenzformeln auf, die sich jedoch später als falsch erwiesen und nicht der realen Struktur des Benzens angenähert sind:
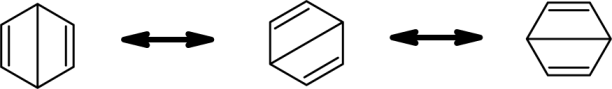
Kelkule hat schließlich zwei Grenzformeln aufgestellt, welche aber energetisch über der Energie des Benzenmoleküls liegen und eben 1,3,5-Cyclohexatrien darstellen. Dennoch sind dies die Grenzformeln, welche am weitesten an die reale Gestalt des Benzenmoleküls angenähert sind:
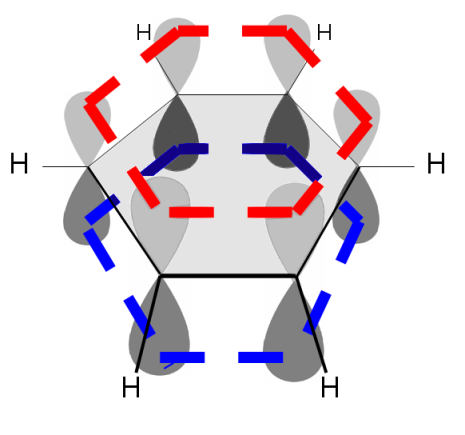
Das Realmolekül liegt dazwischen. Durch die Delokalisation aller Elektronen der
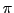
-Bindungen der theoretischen Doppelbindungen senkt es seine Energie ab, so dass ein großes Molekülorbital mit Elektronen entsteht. Dieses Molekülorbital verläuft wie eine Ring über und unter dem Molekül. Man nennt diese Eigenschaften
aromatisch. Der obere Ring ist unten in rot dargestellt, der untere in blau:
In der Mitte des Sechsecks befinden sich sechs Elektronen. Diese können durch Doppelbindungsstriche angedeutet werden, wobei jeder Stich ja zwei Elektronen entspricht. Weiterhin kann man diese Elektronen aber auch einen Kreis darstellen, welcher sechs Elektronen symbolisiert. Der Kreis ist fix auf sechs Elektronen festgelegt. Mit diesem lassen sich keine anderen Elektronenzahlen darstellen. Ganz besonders bei höheren Aromaten sind diese Kreise somit falsch: